
分析 (1)根据该酸的电离方程式知,第一步是完全电离,第二步是部分电离,说明B2-离子水解而HB-不水解,且HB-是弱酸,Na2B是强碱弱酸盐,其水溶液呈碱性;
(2)根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答;
(3)若0.1mol•L-1NaHB溶液的pH=2,说明溶液中C(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步完全电离,第二步部分电离,且含有相同的离子能抑制弱根离子的电离;
(4)根据离子是否电离确定钠离子和酸式酸根离子浓度大小,根据溶液的酸碱性确定氢离子和氢氧根离子浓度相对大小,根据离子来源确定氢离子和B离子相对大小;
(5)CH3COONa和HCl反应生成CH3COOH和NaCl,因CH3COONa的物质的量大于HCl,所以醋酸钠有剩余,溶液中的溶质为NaCl、CH3COOH、CH3COONa,且CH3COONa的物质的量与CH3COOH的物质的量之比为3:2,
①溶液中存在电离平衡H2O?H++OH-、CH3COOH?CH3COO-+H+,水解平衡CH3COO-+H2O?CH3COOH+OH-,据此判断溶液中存在的粒子;
②任何电解质溶液中都存在物料守恒,根据物料守恒判断;
③任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:(1)因为B2-能够水解,所以Na2B溶液显碱性,其水解方程式为:B2-+H2O?HB-+OH-,
故答案为:碱性,B2-+H2O?HB-+OH-;
(2)在Na2B中存在水解平衡:B2-+H2O=HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.HB-不会进一步水解,所以溶液中没有H2B分子,根据物料守恒得c(B2-)+c(HB-)=0.1mol•L-1,故A错误;
B.根据质子守恒:c(OH-)=c(H+)+c(HB-),故B错误;
C.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故C正确;
D.把质子守恒和电荷守恒式相加得:c(Na+)=2c(B2-)+2c(HB-),故D正确;
故答案为:CD;
(3)若0.1mol•L-1NaHB溶液的pH=2,说明溶液中C(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol/L)的c(H+)小于0.11 mol/L,
故答案为:<,H2B第一步电离产生的H+对HB-的电离起了抑制作用;
(4)钠离子不电离,HB-能电离,所以c(Na+)>c(HB-),根据(3)知,溶液呈酸性,则c(H+)>c(OH-),水和HB-都电离出氢离子,则c(H+)>c(B2-),所以该溶液中离子浓度大小顺序是c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),
故答案为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
(5)CH3COONa和HCl反应生成CH3COOH和NaCl,因CH3COONa的物质的量大于HCl,所以醋酸钠有剩余,溶液中的溶质为NaCl、CH3COOH、CH3COONa,且CH3COONa的物质的量与CH3COOH的物质的量之比为3:2,
①溶液中存在电离平衡 H2O?H++OH-、CH3COOH?CH3COO-+H+,水解平衡CH3COO-+H2O?CH3COOH+OH-,所以溶液中存在的粒子有H2O、H+、OH-、CH3COOH、CH3COO-、Na+、Cl-,所以一共有7种粒子,
故答案为:7;
②任何电解质溶液中都存在物料守恒,根据物料守恒得n(CH3COO-)+n(CH3COOH)=0.010mol,
故答案为:CH3COO-;CH3COOH;
③溶液中存在电荷守恒,根据电荷守恒得n(CH3COO-)+n(OH-)+n(Cl-)=n(H+)+n(Na+),所以的n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol,
故答案为:0.006.
点评 本题考查弱电解质电离、离子浓度大小比较,注意该酸第一步完全电离,第二步部分电离,导致HB-能电离但不水解,为易错点,题目难度中等,注意把握溶液中的守恒关系.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 标准状况下,4.0 g CH4中含有共价键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝为负极,镁为正极 | B. | 正极反应式为2H++2e-═H2↑, | ||
| C. | 放电时间越长,溶液中c(H+)越小 | D. | 电解质溶液不可能是硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaSO4的电离程度减小 | B. | BaSO4溶解的量减小 | ||
| C. | c(Ba2+)与c(SO42-)的乘积增大 | D. | 溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
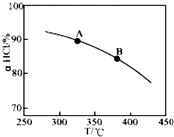 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,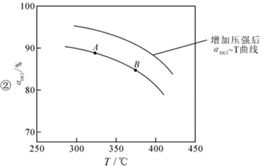 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的盐酸与0.1 mol•L-1的氨水混合,若溶液显中性,则V(盐酸)<V(氨水) | |
| B. | 0.1 mol•L-1的醋酸与等浓度等体积NaOH反应后的溶液中,CH3COOH和CH3COO-浓度关系为:c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1 | |
| C. | pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水) | |
| D. | 已知酸性:HCOOH>HCN,等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3COO-)<c(Na+) | B. | c(CH3COOH)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
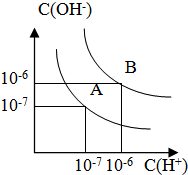 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY4 | D. | X2Y3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com