
| A£® | ĻņĻõĖįÄĘČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖįµĆµ½µÄpH=5µÄ»ģŗĻČÜŅŗ£ŗc£ØNa+ £©=c£ØNO3 - £© | |
| B£® | 1.0 mol•L-1Na2CO3 ČÜŅŗ£ŗc£ØOH-£©=c£ØHCO3-£©+c£ØH+£© | |
| C£® | pH=8.0µÄKHSČÜŅŗÖŠ£¬c£ØK+£©£¾c£ØHS-£©£¾c£ØOH-£©£¾c£ØS2-£©£¾c£ØH+£© | |
| D£® | ½«0.2 mol•L-1µÄijŅ»ŌŖĖįHAČÜŅŗŗĶ0.1 mol•L-1NaOHČÜŅŗµČĢå»ż»ģŗĻŗó£¬ČÜŅŗpH“óÓŚ7£¬Ōņ·“Ó¦ŗóµÄ»ģŗĻŅŗÖŠ£ŗ2c£ØOH-£©+c £ØA-£©=2c£ØH+£©+c£ØHA£© |
·ÖĪö A£®øł¾ŻĪļĮĻŹŲŗćÅŠ¶Ļ£»
B£®øł¾ŻÖŹ×ÓŹŲŗćÅŠ¶Ļ£»
C£®KHSČÜŅŗpH=8£¬ĖµĆ÷HS-Ė®½ā³Ģ¶Č“óÓŚµēĄė³Ģ¶Č£¬×¢ŅāĖ®µÄµēĄė£»
D£®½«0.2 mol•L-1µÄijŅ»ŌŖĖįHAČÜŅŗŗĶ0.1 mol•L-1NaOHČÜŅŗµČĢå»ż»ģŗĻŗó£¬HAÓėNaAµÄÅضČĻąµČ£¬ČÜŅŗpH“óÓŚ7£¬ĖµĆ÷A-Ė®½ā³Ģ¶Č“óÓŚHAµēĄė³Ģ¶Č£¬½įŗĻĪļĮĻŹŲŗć”¢µēŗÉŹŲŗć½ā“š£®
½ā“š ½ā£ŗA£®ĻõĖįÄĘÓėŃĪĖį²»·“Ó¦£¬ĪŽĀŪŹĒ·ń¼ÓČėŃĪĖį£¬¶¼“ęŌŚc£ØNa+£©=c£ØNO3-£©£¬¹ŹAÕżČ·£»
B£®Na2CO3 ČÜŅŗÖŠ“ęŌŚÖŹ×ÓŹŲŗć£¬ĪŖc£ØOH-£©=c£ØHCO3-£©+c£ØH+£©+2c£ØH2CO3£©£¬¹ŹB“ķĪó£»
C£®KHSČÜŅŗpH=8£¬ĖµĆ÷HS-Ė®½ā³Ģ¶Č“óÓŚµēĄė³Ģ¶Č£¬Ņņ»¹“ęŌŚĖ®µÄµēĄė£¬Ōņc£ØH+£©£¾c£ØS2-£©£¬¹ŹC“ķĪó£»
D£®½«0.2mol•L-1µÄijŅ»ŌŖĖįHAČÜŅŗŗĶ0.1mol•L-1µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬HA¹żĮ棬»ģŗĻŗóČÜŅŗµÄpH“óÓŚ7£¬ĖµĆ÷A-Ė®½ā³Ģ¶Č“óÓŚHAµÄµēĄė³Ģ¶Č£¬ČÜŅŗ“ęŌŚµēŗÉŹŲŗć£ŗc£ØOH-£©+c£ØA-£©=c£ØH+£©+c£ØNa+£©£¬“ęŌŚĪļĮĻŹŲŗć£ŗc£ØA-£©+c£ØHA£©=2c£ØNa+£©£¬¶žÕßĮŖŹ½æɵĆ2c£ØOH-£©+c£ØA-£©=2c£ØH+£©+c£ØHA£©£¬¹ŹDÕżČ·£®
¹ŹŃ”AD£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²éĖį¼ī»ģŗĻµÄ¶ØŠŌÅŠ¶ĻŗĶĄė×ÓÅØ¶ČµÄ“óŠ”±Č½ĻĪŹĢā£¬ĢāÄæÄѶČÖŠµČ£¬“šĢā֊עŅāµēŗÉŹŲŗćŗĶĪļĮĻŹŲŗćµÄŌĖÓĆ£®


 Õć½ŠĀæĪ³ĢČżĪ¬Äæ±ź²āĘĄæĪŹ±ĢŲѵĻµĮŠ“š°ø
Õć½ŠĀæĪ³ĢČżĪ¬Äæ±ź²āĘĄæĪŹ±ĢŲѵĻµĮŠ“š°ø ÖÜÖÜĒå¼ģ²āĻµĮŠ“š°ø
ÖÜÖÜĒå¼ģ²āĻµĮŠ“š°ø ĒįĒɶį¹ŚÖܲāŌĀæ¼Ö±ĶØøßæ¼ĻµĮŠ“š°ø
ĒįĒɶį¹ŚÖܲāŌĀæ¼Ö±ĶØøßæ¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 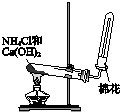 ÓĆaÖʱø²¢ŹÕ¼Æ°±Ęų | B£® | 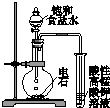 ÓĆbÖʱø²¢¼ģŃéŅŅČ² | ||
| C£® | 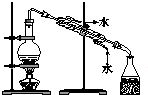 ÓĆcÕōĮóŗ£Ė®µĆµ½µĖ® | D£® | 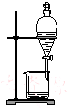 ÓĆd·ÖĄėNa2CO3ČÜŅŗÓėCH3COOC2H5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1£ŗ1 | B£® | 2£ŗ3 | C£® | 3£ŗ5 | D£® | 6£ŗ7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
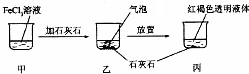
| A£® | ·“Ó¦¹ż³ĢÖŠ²śÉśµÄĘųĢåŹĒCO2 | |
| B£® | ±ūÖŠŅŗĢåæɲśÉś”°¶”“ļ¶ūŠ§Ó¦”± | |
| C£® | ČōŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£¬ÉÕ±ÖŠc£ØCl- £©²»·¢Éś±ä»Æ | |
| D£® | ČōŌŚ±ūÖŠ¼ÓČė¹żĮæŃĪĖį£¬³ä·Ö·“Ó¦ŗóĖłµĆČÜŅŗ×é³ÉÓė¼×ĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ČēĶ¼ĖłŹ¾×°ÖĆĶź³ÉŹµŃéŹŅÖĘ°±Ęų | |
| B£® | 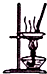 ČēĶ¼ĖłŹ¾×°ÖĆÕō·¢FeCl3ČÜŅŗÖʱøĪŽĖ®FeCl3 | |
| C£® | 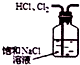 ČēĶ¼ĖłŹ¾×°ÖĆ³żČ„HClÖŠŗ¬ÓŠµÄÉŁĮæCl2 | |
| D£® |  ČēĶ¼ĖłŹ¾×°ÖĆæÉÓĆÓŚ·ÖĄė¶žŃõ»ÆĆĢŗĶ¶žĀČ»ÆĆĢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{11.2X}{5A}$mol-1 | B£® | $\frac{5A}{11.2X}$mol-1 | C£® | $\frac{22.4A}{5X}$mol-1 | D£® | $\frac{22.4X}{5A}$mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃé | ĻÖĻó | ½įĀŪ |
| A | Ķʬ¼ÓČėÅØĻõĖįÖŠ | ²śÉśŗģ×ŲÉ«ĘųĢå | ÅØĻõĖį¾ßÓŠĒæŃõ»ÆŠŌ |
| B | ½«Ņ»Š”æéÄĘ·ÅČėŅŅ“¼ÖŠ | ²śÉś“óĮæĘųÅŻ | øĆŅŅ“¼ÖŠŗ¬ÓŠ½Ļ¶ąĖ® |
| C | ĻņCuSO4ČÜŅŗÖŠĶØČėH2SĘųĢå | ³öĻÖŗŚÉ«³Įµķ | H2SµÄĖįŠŌ±ČH2SO4Ēæ |
| D | ĻņAgClŠü×ĒŅŗÖŠµĪ¼ÓKIČÜŅŗ | °×É«³Įµķ±ä»ĘÉ« | AgIµÄČܽā¶Č“óÓŚAgCl |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ČÜŅŗ | a | b | c | d | e |
| ČÜÖŹ | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com