
目前人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3;
②单质在反应中都只能作氧化剂;
③对应的含氧酸都是强酸;
④氢化物常温下都是气态,所以又叫气态氢化物;
⑤氧化物与水反应都不会再生成气体
A全部 B.只有① C.只有①②③④ D.只有①②④⑤
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列推断正确的是:
A.BF3是三角锥形分子
B.右图中两个分子的关系是手性分子
C.苯分子中C原子均是sp2杂化,每个碳原子有1个参与杂化的2p轨道,共有6个原子共面
D. CH4分子的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g)  pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
A.体系压强不再发生变化
B.反应速率vA∶vB∶vC∶vD=m∶n∶p∶q
C容器内气体的密度不再改变
D. 各组分的物质的量浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下:
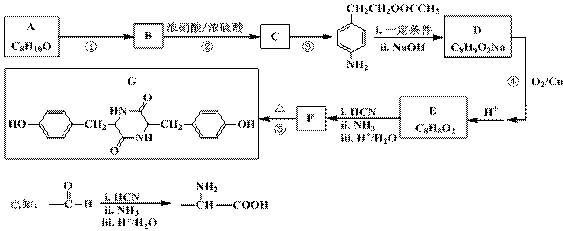
(1)G中所含的官能团有________________;B的核磁共振氢谱有 个峰。
(2)写出反应类型:反(应 ① ___________;反应 ③ ____________。
(3)写出A的名称 ______________;F的结构简式 ______________。
(4)写出反应 ④ 的化学方程式_______________________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式_____________。
(I)属于α-氨基酸,且苯环上有三个互为间位的取代基
(II)与FeCl3溶液作用无显色现象
(III)1 mol该同分异构体与足量NaOH溶液反应时,最多能消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
美国科学家发现:普通盐水在无线电波照射下可燃烧,这一伟大的发现,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是( )
A.分子间作用力 B.氢键 C.共价键 D.离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2 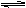
 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。
SO2转化为SO3的热化学方程式是 。
 (2)该反应的化学平衡常数表达式K= 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速度 。该反应K值将 。
压强将 。(填“增大”或“减小”或“不变”)
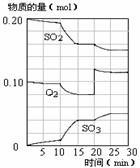
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.缩小容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用。甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:
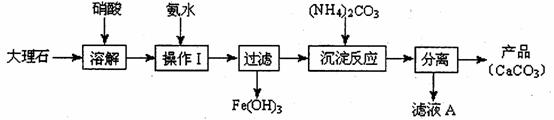
①溶解大理石时,用硝酸而不用硫酸的原因是 。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、 、 。
③“滤液A”中除H+离子外,还含有的阳离子是 ;检验该阳离子的实验方法是:取少量滤液A与 在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:
 2CasO4 2CaO+2S02↑+O2↑。
2CasO4 2CaO+2S02↑+O2↑。
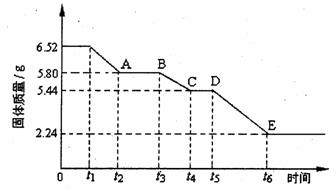
①加热时,该晶体开始发生化学变化的时间是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为 。
③tl~t2时间段固体发生反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com