
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
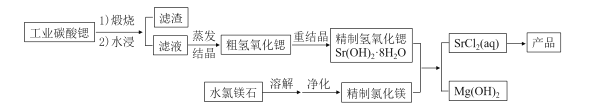
(1)锶与钙元素同主族。金属锶应保存在_______中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2 除杂,写出该过程的离子方程式__________。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______(填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________。
【答案】煤油 SrSO4+4C![]() SrS+4CO↑ Ca(OH)2,MgO 8:1 随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小 SO42-+Sr2+= SrSO4↓ B SrCl2·H2O
SrS+4CO↑ Ca(OH)2,MgO 8:1 随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小 SO42-+Sr2+= SrSO4↓ B SrCl2·H2O
【解析】
流程图可知:工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质,高温煅烧生成对应的氧化物SrO、CaO、MgO、BaO,SrO与水反应生成Sr(OH)2,CaO与水反应生成Ca(OH)2,微溶于水,BaO与水反应生成Ba(OH)2,MgO难溶于水;过滤后滤渣的主要成分为Ca(OH)2,MgO;锶与钙元素同主族,均活泼,所以保存在煤油中;SrSO4与过量焦炭隔绝空气微波加热还原为硫化锶和CO;SrCl2 除SO42-杂质利用的是沉淀法;氢氧化锶完全溶于水,与氯化镁反应后生成氯化锶和氢氧化镁,由于溶液pH变化明显,最简单的方法是测定不同时间反应液的pH;根据脱水失重的比例计算出失水的物质的量,进而求出化学式。据此分析。
(1)锶与钙元素同主族,且锶的金属性大于钙,易与水、乙醇等物质反应,故金属锶应保存在煤油中;答案为:煤油;
(2)根据氧化还原反应原理可知SrSO4与过量焦炭隔绝空气微波加热还原为硫化锶和CO,化学方程式为SrSO4+4C![]() SrS+4CO↑;答案为:SrSO4+4C
SrS+4CO↑;答案为:SrSO4+4C![]() SrS+4CO↑;
SrS+4CO↑;
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质,高温煅烧生成对应的氧化物CaO、MgO、BaO,CaO与水反应生成Ca(OH)2,微溶于水,BaO与水反应生成Ba(OH)2,MgO难溶于水;过滤后滤渣的主要成分为Ca(OH)2,MgO;答案为:Ca(OH)2,MgO;
(4)根据图表信息得质量比为8:1时Sr(OH)2·8H2O的纯度和产率均相对较高;当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小;答案为:8:1;随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小;
(5)“净化”过程中常使用SrCl2 除SO42-杂质,以生成沉淀的方式除杂,离子方程式为SO42-+Sr2+= SrSO4↓;答案为:SO42-+Sr2+= SrSO4↓;
(6)氢氧化锶完全溶于水,与氯化镁反应后生成氯化锶和氢氧化镁,由于溶液pH变化明显,最简单的方法是测定不同时间反应液的pH;答案为:B;
(7)SrCl2·6H2O(M=267g·mol-1)脱水过程采用烘干法在170℃下预脱水,失重达33.7%,失重为H2O的质量。假设SrCl2·6H2O的物质的量1mol,质量为267g,在170℃下预脱水,失重33.7%,失重的质量为267g×33.7%=90g,则失水的物质的量为5mol,则此时产物的化学式为SrCl2·H2O;答案为:SrCl2·H2O;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】聚酯纤维(PET) 结构简式为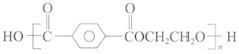 ,其性能优良、应用广泛,产量占合成纤维总量的70%以上,合成原料主要来源于石油和煤的产品。
,其性能优良、应用广泛,产量占合成纤维总量的70%以上,合成原料主要来源于石油和煤的产品。
(1)请你用乙烯和对二甲苯为有机原料,设计该聚酯纤维合成线路: ___________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)。
(2)写出上述流程中发生缩聚反应的化学方程式: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
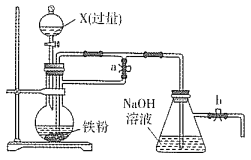
A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是( )

A.图甲:进行中和热的测定
B.图乙:比较 HCl、H2CO3和H2SiO3的酸性强弱
C.图丙:验证 CuCl2对 H2O2 分解有催化作用
D.图丁:验证 2NO2(g)![]() N2O4 (g) △H<0
N2O4 (g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
B.对于2HI(g) ![]() H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g) +I2(g),达平衡后,缩小容器体积可使体系颜色变深
C.氨水中加入NaOH固体有利于氨气的溢出
D.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是
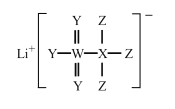
A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解冶炼铝的过程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔点的作用。
(1)基态氟原子中,电子占据的最高能层的符号为______,电子占据最高能级上的电子数为______。
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为______________。
②1molCO2中含有的σ键数目为________,其中C原子的杂化方式为_________;CO2与SCNˉ互为等电子体,SCNˉ的电子式为_________。
③Na2O的熔点比NaF的高,其理由是:_________。
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是________(填微粒符号)。
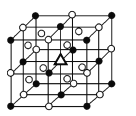
(4)冰晶石稀溶液中存在的化学键有________(填标号)。
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
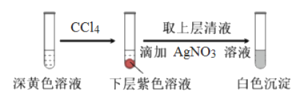
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
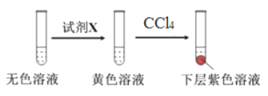
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com