
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料,可用作分析试剂及鞣革的还原剂,易溶于水,受热、遇酸易分解。Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。工业上常利用含硫废水生产Na2S2O3·5H2O,某化学兴趣小组在实验室中用如图所示装置(加热装置及部分夹持装置已略去)模拟其生产过程并探究其化学性质。
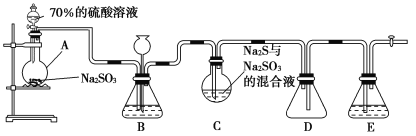
烧瓶C中发生如下反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ①
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ②
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) ③
Na2S2O3(aq) ③
Ⅰ.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是_________;装置D的作用是______________;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用________(填字母)。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是_________;所制得的粗产品可以通过________方法进一步提纯得到纯Na2S2O3·5H2O。
Ⅱ.测定产品纯度
准确称取w g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10 mol·L-1I2的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
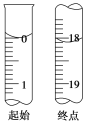
(3)滴定至终点时的现象:______________。滴定起始和终点时I2的标准溶液液面位置如图所示,则消耗I2的标准溶液的体积为________mL。产品的纯度为________(设Na2S2O3·5H2O的相对分子质量为M,列出用M、w表示的表达式)。
Ⅲ.探究Na2S2O3的部分化学性质
(4)(提出假设)
假设一:Na2S2O3与Na2SO4的结构相似,化学性质也应该相似,因此,室温时Na2S2O3溶液的pH=7。
假设二:从S的化合价推测Na2S2O3具有较强的还原性。
(验证假设) 配制适量Na2S2O3溶液,进行如下实验,请将实验补充完整。
实验操作 | 实验结论 或现象 | 现象解释(用离子 方程式表示) | |
假设一 | ________ | 溶液pH=8 | ________ |
假设二 | 向溴水中 滴入适量 Na2S2O3 溶液 | 溴水褪色 | ________ |
实验结论:________________________________________。
Ⅳ.Na2S2O3的应用
(5)Na2S2O3的商品名为“海波”,俗称“大苏打”,化学上常用于滴定实验。为测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00 mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量稀H2SO4,滴加几滴指示剂,用0.10 mol·L-1 Na2S2O3标准溶液滴定至终点,进行3次平行实验后,测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7)=________mol·L-1。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2S2O32-+I2=S4O62-+2I-)
Ⅴ.探究与反思
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将实验方案补充完整。
取适量产品配成稀溶液,___________________(所需试剂从BaCl2溶液、稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)。
【答案】检查装置气密性 防止倒吸 C 若SO2过量,溶液显酸性,产物分解,产率降低 重结晶 溶液由无色变蓝色,且半分钟内不褪色 18.10 ![]() % 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,再与标准比色卡对照(或用pH计测量Na2S2O3溶液的pH) S2O32-+H2O
% 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,再与标准比色卡对照(或用pH计测量Na2S2O3溶液的pH) S2O32-+H2O![]() HS2O3-+OH- S2O32-+4Br2+5H2O=2SO42-+8Br-+10H+ Na2S2O3溶液呈碱性,且具有还原性(或假设一不成立,假设二成立) 0.05 滴加足量BaCl2溶液有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀部分溶解,并产生有刺激性气味的气体,则可确定产品中含有Na2SO3和Na2SO4
HS2O3-+OH- S2O32-+4Br2+5H2O=2SO42-+8Br-+10H+ Na2S2O3溶液呈碱性,且具有还原性(或假设一不成立,假设二成立) 0.05 滴加足量BaCl2溶液有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀部分溶解,并产生有刺激性气味的气体,则可确定产品中含有Na2SO3和Na2SO4
【解析】
(1)有气体参加的反应,组装好仪器,应该先检查气密性,装置D可以防止倒吸现象的发生,装置B观察SO2的生成速率,试剂不能溶解、反应消耗SO2;
(2)根据SO2的水溶液显酸性对硫代硫酸钠的存在的影响分析;利用Na2S2O3·5H2O的溶解度受温度的影响变化较大分析提纯方法;
(3)利用Na2S2O3与I2反应产生I-,及过量的I2遇淀粉溶液变为蓝色判断滴定终点,根据物质反应转化关系计算Na2S2O3的物质的量及质量,进而可得其纯度;
(4)根据测定溶液pH方法确定实验操作,利用盐的水解规律分析溶液pH大小;
利用Br2具有氧化性,Na2S2O3具有还原性,二者发生氧化还原反应分析判断;
(5)根据反应方程式,找到Na2S2O3与K2Cr2O7的关系式,然后计算;
(6)利用BaSO4不溶于水,也不溶于酸,而BaSO3不溶于水,却能溶于酸,反应放出SO2分析。
(1)组装好仪器,在加入药品前应先检查装置的气密性;装置D为安全瓶,可以防止倒吸现象的发生;装置B的作用之一是观察SO2的生成速率,则所选试剂应不与SO2反应,且SO2在其中的溶解度较小,最好选用饱和NaHSO3溶液,故合理选项是C;
(2)由题意可知硫代硫酸钠受热、遇酸易分解,若SO2过量,SO2溶于水复原产生H2SO3,使溶液显酸性,导致硫代硫酸钠分解,使物质产率降低;Na2S2O3·5H2O的溶解度受温度的影响变化较大,所以通常采用重结晶的方法提纯该晶体产物。
(3)Na2S2O3与I2反应产生I-,因此当Na2S2O3反应完全,过量的I2遇淀粉溶液变为蓝色。故滴定至终点时,溶液颜色的变化是由无色变为蓝色,且半分钟内不褪色。根据滴定起始和终点的液面位置图可知反应消耗I2的标准溶液的体积为18.10 mL。n(I2)=0.10 mol/L×0.01810L=1.81×10-3mol;根据2S2O32-+I2=S4O62-+2I-中关系式2S2O32-~I2可知n(Na2S2O3)=2×1.81×10-3mol=3.62×10-3mol,所以产品的纯度为![]() ×100%=
×100%=![]() %。
%。
(4)假设一的实验结论是溶液的pH=8,则实验目的是测定溶液的pH,具体操作是用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,半分钟后将试纸颜色与标准比色卡对照,即得该溶液的pH大小。Na2S2O3是强碱弱酸盐,在溶液中S2O32-发生水解作用,消耗水电离产生的H+,使水的电离平衡正向移动,最终当达到平衡时,溶液中c(OH-)>c(H+),所以溶液呈碱性,水解反应的离子方程式是S2O32-+H2O![]() HS2O3-+OH-。假设二的实验现象是溴水褪色,证明Na2S2O3有还原性,发生反应的离子方程式是S2O32-+4Br2+5H2O=2SO42-+8Br-+10H+,使溶液褪色,故实验结论是Na2S2O3溶液呈碱性,且Na2S2O3具有还原性。
HS2O3-+OH-。假设二的实验现象是溴水褪色,证明Na2S2O3有还原性,发生反应的离子方程式是S2O32-+4Br2+5H2O=2SO42-+8Br-+10H+,使溶液褪色,故实验结论是Na2S2O3溶液呈碱性,且Na2S2O3具有还原性。
(5)根据所给离子方程式Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2S2O32-+I2=S4O62-+2I-可得对应关系式K2Cr2O7~6Na2S2O3,则c(K2Cr2O7)=![]() ×n(Na2S2O3)÷V=
×n(Na2S2O3)÷V=![]() ×0.10mol/L×0.03 L÷0.01 L=0.05mol/L。
×0.10mol/L×0.03 L÷0.01 L=0.05mol/L。
(6)题干中给出Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。则可取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成。经过滤并用蒸馏水洗涤沉淀后,向沉淀中加入足量稀盐酸,若固体部分溶解,产生无色有刺激性气味的气体,就证明产品中含有Na2SO3和Na2SO4。


科目:高中化学 来源: 题型:
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的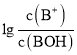 或
或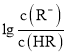 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()
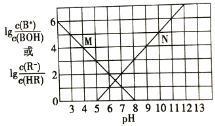
A.M线表示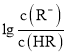 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
A.X、W元素的离子半径 W<X
B.一定条件下,W单质可以与Z元素的氢化物发生化学反应
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定实验是中学化学的重要实验之一。下列有关说法错误的是![]() 滴定过程的其他操作均正确
滴定过程的其他操作均正确![]()
A.滴定管洗净后,应用待装液润洗![]() 次
次
B.用![]() 酸式滴定管量取
酸式滴定管量取![]()
![]() 溶液
溶液
C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.滴定前滴定管内无气泡,终点读数时有气泡,所滴加液体体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
D.有机物![]() 分子中所有碳原子不可能在同一个平面上
分子中所有碳原子不可能在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子排布式为_________________。钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是______________,VO43-的立体构型为__________。
(2)2-巯基烟酸氧钒配合物(图1)是副作用较小的有效调节血糖的新型药物。
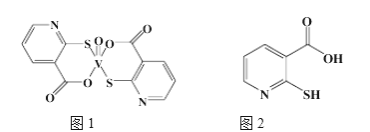
①该药物中N原子的杂化方式是____________,其所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是_________________________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,图4为该晶胞的俯视图,该晶胞的密度为________________ g·cm-3(列出计算式即可)。
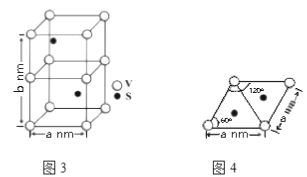
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是
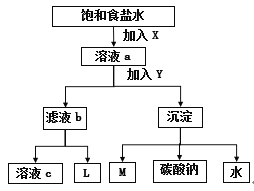
A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com