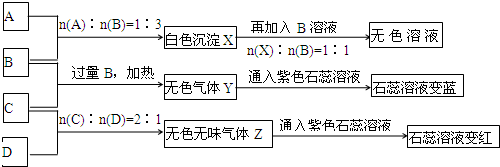
解:B、D的焰色反应均为黄色证明含钠元素.C是一种强酸的酸式盐可以判断为NaHSO
4,将C加入BaCl
2溶液有不溶于盐酸的白色沉淀生成为BaSO
4;转化关系中A+3B→白色沉淀X,X+B→无色溶液,根据生成沉淀和沉淀溶解所用B的定量关系可以推断,A为铝盐,B为NaOH,X为Al(OH)
3;转化关系中过量的B(NaOH)和C反应生成气体Y使石蕊溶液变蓝证明是氨气,即判断C为硫酸氢铵,Y为NH
3,C和D按2:1反应生成气体Z,能使石蕊试液变红,说明气体是酸性气体,结合D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末,判断D为Na
2CO
3,Z为CO
2;
(1)X(Al(OH)
3)与B(NaOH)反应的离子方程式为:Al(OH)
3+OH
-=AlO
2-+2H
2O,
故答案为:Al(OH)
3+OH
-=AlO
2-+2H
2O;
(2)推断D溶液为碳酸钠溶液,pH值大于7,原因是碳酸根离子水解,离子方程式为:CO
32-+H
2O

HCO
3-+OH
-;HCO
3-+H
2O?H
2CO
3+OH
-,故答案为:CO
32-+H
2O

HCO
3-+OH
-;HCO
3-+H
2O?H
2CO
3+OH
-;
(3)C(NH
4HSO
4)与过量B(NaOH)反应(加热)的离子方程式为:NH
4++H
++2OH
-
NH
3↑+2H
2O,
故答案为:NH
4++H
++2OH
-
NH
3↑+2H
2O
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,依据电荷守恒可知:C(Na
+)+C(NH
4+)+C(H
+)=C(OH
-)+2C(SO
42-),C(H
+)=C(OH
-) C(Na
+)+C(NH
4+)=2C(SO
42-),恰好反应发生的化学反应方程式为:NH
4HSO
4+2NaOH=Na
2SO
4+H
2O+NH
3?H
2O,溶液呈碱性,若呈中性,硫酸氢铵稍过量,或氢氧化钠量少,则该溶液中离子浓度从大到小的顺:C(Na
+)>C(SO
42-)>C(NH
4+)>C(H
+)=C(OH
-),
故答案为:C(Na
+)>C(SO
42-)>C(NH
4+)>C(H
+)=C(OH
-)
(5)Y为NH
3,在同主族的同类物质中,氮元素非金属性最强,所以氢化物的稳定性最强,分子稳定性最强是,氢化物的沸点取决于分子间的作用力,结构相似的分子,相对分子质量越大,沸点越高,但氨气分子间存在氢键,沸点反常的高,
故答案为:是 是;
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH
2O时的反应热分别为△H
1,△H
2,△H
3,醋酸是弱电解质存在电离平衡,和氢氧化钠反应促进电离需吸收热量,浓硫酸溶解过程溶液温度升高,所以反应生成1mol水时的焓变大小需要考虑正负号,反应是放热,焓变是负值,大小为:△H
1>△H
2>△H
3,
故答案为::△H
1>△H
2>△H
3 ;
分析:依据题意和转化关系,B、D的焰色反应均为黄色证明含钠元素.C是一种强酸的酸式盐可以判断为NaHSO
4,将C加入BaCl
2溶液有不溶于盐酸的白色沉淀生成为BaSO
4;转化关系中A+3B→白色沉淀X,X+B→无色溶液,根据生成沉淀和沉淀溶解所用B的定量关系可以推断,A为铝盐,B为NaOH,X为Al(OH)
3;转化关系中过量的B(NaOH)和C反应生成气体Y使石蕊溶液变蓝证明是氨气,即判断C为硫酸氢铵,Y为NH
3,C和D按2:1反应生成气体Z,能使石蕊试液变红,说明气体是酸性气体,结合D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末,判断D为Na
2CO
3,Z为CO
2;依据判断出的物质分析回答问题;
点评:本题考查了物质转化关系和物质性质的综合应用,主要考查焰色反应、物质定量反应关系,盐类水解应用,溶液中离子浓度大小比较,反应中和热的判断,氢化物的稳定性和沸点大小比较依据的应用,铝及其化合物性质的判断应用,题目综合性较大.

 HCO3-+OH-;HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O
HCO3-+OH-;HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O  HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;
HCO3-+OH-;HCO3-+H2O?H2CO3+OH-; NH3↑+2H2O,
NH3↑+2H2O, NH3↑+2H2O
NH3↑+2H2O

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案