
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
分析 A、钠原子中含11个电子;
B、标况下酒精为液体;
C、12C的摩尔质量为12g/mol,求出12C的物质的量,然后根据原子个数N=nNA来计算;
D、求出硫酸的物质的量,然后根据硫酸能电离出2个氢离子来分析.
解答 解:A、钠原子中含11个电子,故1mol钠中含11mol即11NA个电子,故A错误;
B、标况下酒精为液体,故 22.4L酒精的物质的量大于1mol,则分子个数大于NA个,故B错误;
C、12C的摩尔质量为12g/mol,故12g12C的物质的量为1mol,则原子个数N=nNA=NA个,故C正确;
D、1mol/L1L硫酸溶液中硫酸的物质的量n=CV=1mol/L×1L=1mol,而硫酸能电离出2个氢离子,且水也能电离出少量的氢离子,故1mol硫酸溶液中氢离子个数多于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
可逆反应:2NO2 2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
下列说法不正确的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.用热的纯碱溶液去油污效果更好
C.制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法
D.室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应的活化能小于100kJ/mol | |
| B. | 逆反应活化能一定小于100kJ/mol | |
| C. | 正反应活化能小于100kJ/mol | |
| D. | 正反应活化能比逆反应活化能大100kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | M层的电子数为K层电子数的3倍 |
| Y | 短周期中最活泼的金属元素 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
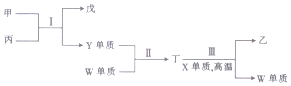
| A. | 原子半径:X<Y<Z | |
| B. | 反应Ⅰ中丙既能做氧化剂又作还原剂 | |
| C. | 非金属性:X>Y>W | |
| D. | 反应Ⅱ和Ⅲ反应均属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H3PO4>H2SO4>HClO4 | B. | 碱性:Mg(OH)2>Ca(OH)2>KOH | ||
| C. | 热稳定性:H2S>H2O>HF | D. | 氧化性:F2>Cl2>Br2>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com