
| A. | 4.5 mol HCl | B. | 2.5 mol H2O | ||
| C. | 108.5 g 33.6%的盐酸 | D. | 145 g 50.3%的盐酸 |
分析 用惰性电极电解饱和食盐水时,开始时阳极反应式为2Cl─-2e-=Cl2↑,阴极反应式2H++2e-=H2↑,阴极生成4.5mol氢气转移电子物质的量=4.5mol×2=9mol,如果阳极生成的气体完全是氯气,则阳极转移电子物质的量=2.5mol×2=5mol<9mol,说明阳极还有OH-放电生成O2,设阳极生成氯气物质的量为xmol、氧气物质的量为ymol,结合转移电子守恒得:
$\left\{\begin{array}{l}{x+y=2.5}\\{2x+4y=4.5mol×2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.5}\\{y=2}\end{array}\right.$
根据Cl原子守恒得析出n(HCl)=2n(Cl2)=2×0.5mol=1mol,根据H原子守恒得反应的n(H2O)=2n(O2)=2×2mol=4mol,根据“析出什么加入什么”原则加入物质能使溶液恢复原状.
解答 解:用惰性电极电解饱和食盐水时,开始时阳极反应式为2Cl─-2e-=Cl2↑,阴极反应式2H++2e-=H2↑,阴极生成4.5mol氢气转移电子物质的量=4.5mol×2=9mol,如果阳极生成的气体完全是氯气,则阳极转移电子物质的量=2.5mol×2=5mol<9mol,说明阳极还有OH-放电生成O2,设阳极生成氯气物质的量为xmol、氧气物质的量为ymol,结合转移电子守恒得:
$\left\{\begin{array}{l}{x+y=2.5}\\{2x+4y=4.5mol×2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.5}\\{y=2}\end{array}\right.$
根据Cl原子守恒得析出n(HCl)=2n(Cl2)=2×0.5mol=1mol,根据H原子守恒得反应的n(H2O)=2n(O2)=2×2mol=4mol,根据“析出什么加入什么”原则加入物质能使溶液恢复原状,
根据以上分析知,要使溶液恢复原状需要加入HCl和水,m(HCl)=1mol×36.5g/mol=36.5g,m(H2O)=4mol×18g/mol=72g,
108.5 g 33.6%的盐酸中m(HCl)=108.5g×33.6%=36.5g,m(H2O)=108.5g-36.5g=72g,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,正确判断阳极产物成分是解本题关键,注意转移电子守恒的灵活运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | CH3CH2OH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是2-甲基-3,4-二乙基戊烷 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Ag2O(s)═4Ag (s)+O2(g) | B. | 2CO2(g)═2CO(g)+O2 (g) | ||
| C. | 6C(s)+6 H2O(l)═C6H12O6 (s) | D. | CaCO3(s)═CaO(s)+2CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
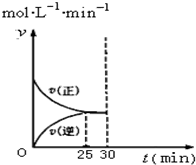 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示: 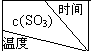 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
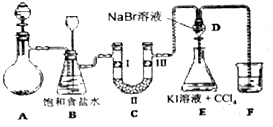
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Cl2是氧化剂,KOH是还原剂 | |
| B. | KCl是还原产物,KClO3是氧化产物 | |
| C. | 反应过程中3个氯分子共转移6个电子 | |
| D. | 被氧化的氯原子是被还原的氯原子的5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com