
【题目】I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___K。
II.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___。
(2)反应前A的物质的量浓度是___。
(3)10s末,生成物D的浓度为____。
【答案】![]() 吸热 1103.15 0.04mol/(L·s) 1.5mol/L 0.4mol/L
吸热 1103.15 0.04mol/(L·s) 1.5mol/L 0.4mol/L
【解析】
I.(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动;
(3)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),说明平衡常数K=1,查表可确定对应的温度。
II.利用三等式求解。
I.(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,CO2(g)+H2(g)![]() CO(g)+H2O(g)反应的平衡常数K=
CO(g)+H2O(g)反应的平衡常数K=![]() 。答案为:
。答案为:![]() ;
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热。答案为:吸热;
(3)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),说明平衡常数K=1,故温度为830℃,转化为热力学温度,830+273.15=1103.15K。答案为:1103.15;
II. 
(1)用C表示10s内反应的平均反应速率为![]() = 0.04mol/(L·s)。答案为:0.04mol/(L·s);
= 0.04mol/(L·s)。答案为:0.04mol/(L·s);
(2)反应前A的物质的量浓度是![]() =1.5mol/L。答案为:1.5mol/L;
=1.5mol/L。答案为:1.5mol/L;
(3)10s末,生成物D的浓度为![]() = 0.4mol/L。答案为:0.4mol/L。
= 0.4mol/L。答案为:0.4mol/L。


科目:高中化学 来源: 题型:
【题目】常温时,将足量的CaCO3固体分别加入同体积下列各溶液中,CaCO3溶解最少的是
A.1 mol·L-1的Na2CO3溶液B.2 mol·L-1的K2CO3溶液
C.2 mol·L-1的HCl溶液D.1 mol·L-1的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮及其化合物的转化很有意义。下面是氮的氧化物在几种不同情况下的转化:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) H= -196.6 kJmol-1
2SO3(g) H= -196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) H=-113.0kJmol-1
2NO2(g) H=-113.0kJmol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为:______________。
②a.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使其反应达到平衡,正反应速率随时间变化的示意图如图1所示。反应在c点________(“达到”或“未到”)平衡状态。
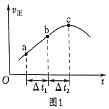
b.开始时,分别在该容器中加入Ⅰ:2mol SO2(g)和2 mol NO2(g)
Ⅱ:2 mol SO3(g)和2 mol NO(g)。则反应达到平衡时,比较容器Ⅰ和容器Ⅱ中反应平衡常数:Ⅰ____Ⅱ(填“>”“=”或“<”)。 .
(2)已知在温度为T时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 molL-1,c始(H2O)=1 molL-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是________。此时刻v正________v逆(填“>”或“<”)。 .
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 molL-1,c始(H2O)=1 molL-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是________。此时刻v正________v逆(填“>”或“<”)。 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
B.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
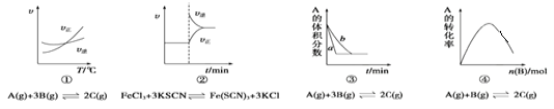
A.①是其他条件一定时,反应速率随温度变化的图像,则逆反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:
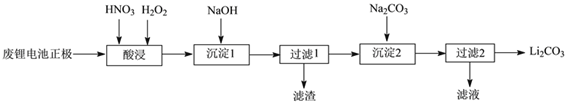
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式_________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是_________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:

(1)写出生成A的化学方程式__________________;
(2)写出苯和液溴反应生成E的化学方程式________;其反应类型为____________。
(3)C的结构简式为___________;由B生成C的反应类型为____________。
(4)乳酸(![]() )生成六元环酯的化学方程式:__________
)生成六元环酯的化学方程式:__________
(5)乙酸苯酚酯(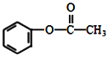 )在热的NaOH溶液中反应的化学方程式:__________
)在热的NaOH溶液中反应的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用Cu片作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用两个铜片作电极电解AgNO3溶液:Cu+2Ag+![]() 2Ag+Cu2+
2Ag+Cu2+
C.用石墨作电极电解FeCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用石墨作电极电解CuBr2溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com