
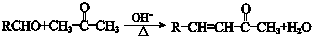
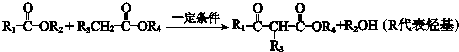
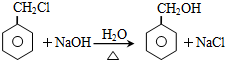 ;
; .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.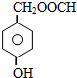 .
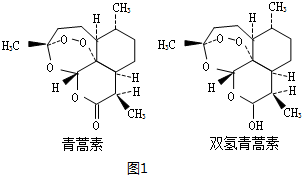
. 分析 I.A.由青蒿素分子结构可知,含有过氧键、酯基和醚键;
B.根据青蒿素的结构简式确定其分子式;
C.由双氢青蒿素转化为青蒿素是羟基转化为羰基;
D.由结构可知,双氢青蒿素含有3个六元环、1个七元环;
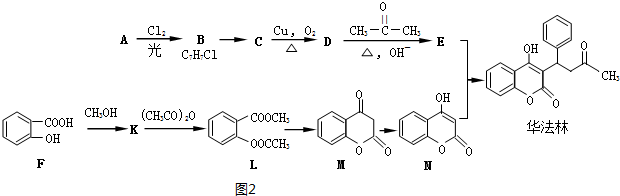
Ⅱ.D与丙酮发生信息①的反应生成E,N与E反应得到华法林,由N、华法林的结构简式,可推知E为 ,则D为
,则D为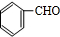 ,C为
,C为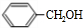 ,B为
,B为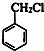 ,A为
,A为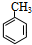 .F与甲醇发生酯化反应生成K为
.F与甲醇发生酯化反应生成K为 ,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,据此解答.
,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,据此解答.
解答 解:I.A.由青蒿素分子结构可知,含有过氧键、酯基和醚键,故A正确;
B.根据青蒿素的结构简式,确定其分子式为C15H22O5,故B正确;
C.由双氢青蒿素转化为青蒿素是羟基转化为羰基,属于氧化反应,故C正确;
D.由结构可知,双氢青蒿素含有3个六元环、1个七元环,故D错误,
故选:D;
Ⅱ.D与丙酮发生信息①的反应生成E,N与E反应得到华法林,由N、华法林的结构简式,可推知E为 ,则D为
,则D为 ,C为
,C为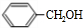 ,B为
,B为 ,A为
,A为 .F与甲醇发生酯化反应生成K为
.F与甲醇发生酯化反应生成K为 ,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N.
,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N.
(1)由上述分析可知,A为 ,名称是:甲苯,故答案为:甲苯;
,名称是:甲苯,故答案为:甲苯;
(2)C生成D发生醇的催化氧化,属于氧化反应,E与N合成华法林的反应类型是加成反应,
故答案为:氧化反应;加成反应;
(3)B→C发生卤代烃的水解反应,反应化学方程式是: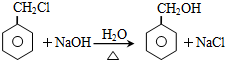 ,
,
故答案为: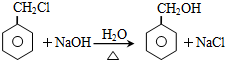 ;
;
(4)E的结构简式是 ,L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
,L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 ,
,
故答案为: ;
; ;
;
(5)K( )有多种同分异构体,满足下列条件的K的同分异构体:
)有多种同分异构体,满足下列条件的K的同分异构体:
①属于芳香族化合物,含有苯环,②遇到FeCl3显紫色,说明含有酚羟基,③可发生水解反应,说明含有酯基,含有2各取代基,其中一个为-OH,另外的取代基为-OOCCH3、或者-COOCH3,或者-CH2OOCH各有邻、间、对3种(包含K在内),可以含有3个取代基,为-OH、-OOCH、-CH3,当-OH、-OOCH处于邻位时,-CH3有4种位置,当-OH、-OOCH处于间位时,-CH3有4种位置,当-OH、-OOCH处于对位时,-CH3有2种位置,故符合条件的同分异构体(除K外)有18种,其中满足核磁共振氢谱图显示峰值比为1:2:2:2:1的同分异构体的结构简式为: ,
,
故答案为:18; .
.
点评 本题考查有机物的推断与合成、官能团的结构与性质、有机方程式的书写,需要对给予的信息进行利用,较全面地考查学生的有机化学基础知识和逻辑思维能力,也有利于培养学生的自学能力和知识的迁移能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
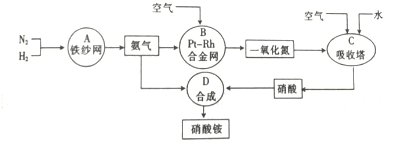
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 高分子材料可能导电,如聚乙炔 | |
| C. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| D. | 人造刚玉的主要成分是MgO,熔点很高,可用作高级耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2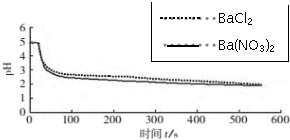 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
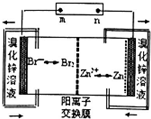
| A. | 充电时Zn2+通过阳离子交换膜由左侧流向右侧 | |
| B. | 放电时每转移2mol电子负极增重130g | |
| C. | 充电时阴极的电极反应式为Br2+2e-=2Br- | |
| D. | 若将电解液改为氯化锌溶液放电效果更好更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com