
工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如下图所示,已知CaSO4的Ksp=9.1×10-6,CaCO3的Ksp=2.8×10-9 ,请回答:
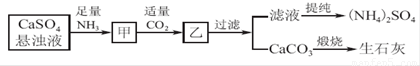
(1)向甲中通入过量CO2_____(填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_______________________________________________________________。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是________(填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松,易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为____________________________________。
②请分析CaSO4转化为CaCO3的原理:__________________________________________。
(1)不(1分) 通入过量的CO2会使CO32-转化为HCO3-(1分),从而CO32-浓度减小,不利于CaSO4转化为CaCO3 (1分)[类似的意思参照 给分]
(2)(1分)(NH4)2CO3 或碳酸铵(写碳酸氢铵不给分)
(3)(5分)①(2分)CaSO4(s)+CO32-(aq) 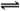 CaCO3(s)+SO42-(aq) 【任错1处0分】
CaCO3(s)+SO42-(aq) 【任错1处0分】
②(3分)CaSO4存在沉淀溶解平衡CaSO4(s)
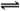 Ca2+(aq)+SO42-(aq)[1分] ,当加入Na2CO3溶液后,CO32-与Ca2+结合生成溶度积更小的CaCO3沉淀(1分),溶液中Ca2+浓度减少,使CaSO4的溶解平衡向溶解的方向移动(1分)
Ca2+(aq)+SO42-(aq)[1分] ,当加入Na2CO3溶液后,CO32-与Ca2+结合生成溶度积更小的CaCO3沉淀(1分),溶液中Ca2+浓度减少,使CaSO4的溶解平衡向溶解的方向移动(1分)
【解析】
试题分析:⑵向氨化的CaSO4悬浊液中通入适量CO2,二氧化碳会跟里面的氨全部反应生成碳酸铵。
考点:考查难溶电解质的溶解平衡。


科目:高中化学 来源: 题型:阅读理解
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
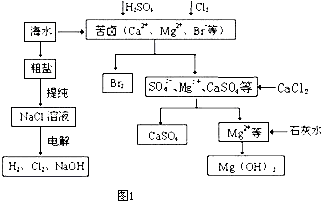
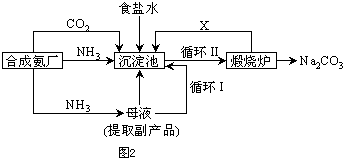
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com