
 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.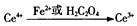
分析 (1)结合化学式和固体残留率计算方法金属分析;
(2)质量分数为60%、密度为1.47g/cm3的硫酸中溶质硫酸物质的量浓度c=$\frac{1000×ρ×w%}{M}$,得到氢离子浓度,用水定容至l000mL是稀释20倍,计算得到氢离子浓度;
(3)称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液.发生反应为Ce4++Fe2+=Fe3++Ce3+,H2C2O4+2Ce4+=2Ce3++2CO2↑+2H+,将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL,与亚铁离子和草酸反应的Ce4+离子物质的量=0.100.00L×0.2000mol/L=0.02mol,Ce4++Fe2+=Fe3++Ce3+,250.00mL溶液中剩余Ce4+离子物质的量=0.01000mol/L×0.02000L×$\frac{250}{25}$=0.002mol,设固体混合物中FeC2O4•2H2O物质的量为x,Fe(C2O4)3•4H2O物质的量为y,结合质量关系和消耗Ce4+物质的量列式计算.
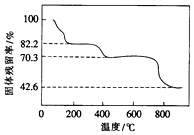
解答 解:(1)将Ce(SO4)2•4H2O(摩尔质量为404g/mol)在空气中加热分解,
A.若为Ce(SO4)2 固体残留率=$\frac{332}{404}$×100%=782.2%,
B.若为Ce2(SO4)3 原子守恒计算固体残留率=$\frac{568}{404×2}$×100%=70.3,
C.若为CeOSO4 ,固体残留率=$\frac{252}{404}$×100%=62.4%,
所以当固体残留率为70.3%时,所得固体可能为Ce2(SO4)3,选B,
故答案为:B;
(2)质量分数为60%、密度为1.47g/cm3的硫酸中溶质硫酸物质的量浓度c=$\frac{1000×ρ×w%}{M}$=$\frac{1000ml/L×1.47g/c{m}^{3}×60%}{98g/mol}$=9mol/L,氢离子浓度为18mol/L,50ml溶液稀释为1000ml,用水定容至l000mL是稀释20倍,氢离子浓度=$\frac{18mol/L}{20}$=0.9mol/L,
故答案为:0.9;
(3)称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液.发生反应为Ce4++Fe2+=Fe3++Ce3+,H2C2O4+2Ce4+=2Ce3++2CO2↑+2H+,将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL,与亚铁离子和草酸反应的Ce4+离子物质的量=0.100.00L×0.2000mol/L=0.02mol,Ce4++Fe2+=Fe3++Ce3+,250.00mL溶液中剩余Ce4+离子物质的量=0.01000mol/L×0.02000L×$\frac{250}{25}$=0.002mol,设固体混合物中FeC2O4•2H2O物质的量为x,Fe(C2O4)3•4H2O物质的量为y,得到
Ce4++Fe2+=Fe3++Ce3+,H2C2O4+2Ce4+=2Ce3++2CO2↑+2H+,
x x x+3y 2(x+3y)
180x+448y=1.124
x+2(x+3y)=0.02-0.002=0.018
x=0.0005mol
y=0.0005mol
固体混合物中FeC2O4•2H2O的质量分数=$\frac{0.0005mol×180g/mol}{1.124g}$×100%=80.07%,
点评 本题考查了物质组成的实验探究、物质性质和物质反应的定量关系的分析判断,主要是滴定实验过程的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为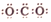 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |
| Y | Z |
| A. | 若 X 通过共用三对电子可形成 X2 分子,Z 在周期表中的位置是第三周期Ⅵ族 | |
| B. | 若 X、Y、Z 都是金属,则它们的最高价氧化物的水化物都是强碱 | |
| C. | 若它们原子最外层电子数之和为 13,则它们均为非金属元素 | |
| D. | 若 X、Y、Z 都是非金属,则三者形成的简单氢化物中,Z 的氢化物沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 天平所配的砖码有脏污 | |
| B. | 药品保存不善,露置时间过长 | |
| C. | 定容时液面与容量瓶壁交界处到达刻度就定容完毕 | |
| D. | 溶解步骤完成后,洗涤次数过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| B. | 在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变 | |
| C. | 已知Ksp(AgCl)>Ksp(AgI),则反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 | |
| D. | 在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 二 | C | N | ① | |||||
| 三 | ② | ③ | ④ | P | ⑤ | ⑥ |
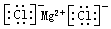 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
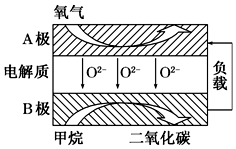 以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.下列说法错误的是( )
以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图.下列说法错误的是( )| A. | 以甲烷为燃料,其成本大大低于以氢气为燃料的传统燃料电池 | |
| B. | A电极为电池正极,发生还原反应 | |
| C. | B电极反应式为CH4+4O2--8e-═CO2+2H2O | |
| D. | 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol•L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为22.4L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 食盐水和泥沙 | D. | 乙酸丁酯和1-丁醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com