
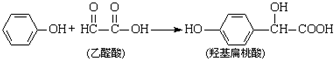
| A. | 该反应是取代反应 | |
| B. | 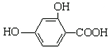 和羟基扁桃酸互为同系物 和羟基扁桃酸互为同系物 | |
| C. | 1个烃基扁桃酸分子中最多有17个原子共平面 | |
| D. | 1mol羟基扁桃酸分子最多能分别和1mol NaHCO3、2mol Na0H、3mol Na、4mol H2发生反应 |
分析 由合成反应可知,发生-CHO的加成反应,只有一种生成物,乙醛酸中只有-CHO与氢气发生加成反应,对羟基扁桃酸中含酚-OH、-COOH,以此来解答.
解答 解:A.由合成反应可知,发生-CHO的加成反应,故A错误;
B.因官能团不同,二者不能互为同系物,故B错误;
C.该有机物分子中总共含有17个原子,由于苯环共平面、单键可以转动,所以该有机物分子中所有原子可能共平面,即最多17个原子共平面,故C正确;
D.羟基扁桃酸中只有苯环与氢气发生加成反应,则需要3mol氢气,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,题目难度中等,把握官能团与性质的关系即可解答,注意合成反应为加成反应和醛的性质为解答的关键,选项C为易错点.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在家可用食醋代替CO2来增强漂白粉的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
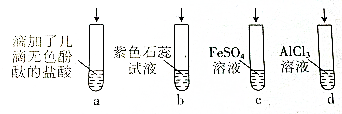
| A. | 若滴加过量的浓氨水,试管a中溶液由无色变红色 | |
| B. | 试管b中溶液由紫色变为蓝色 | |
| C. | 试管c中先有白色沉淀,后变为灰绿色,然后变为红褐色 | |
| D. | 试管d中先有白色沉淀,后白色沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 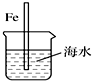 图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. |  图中,发生吸氧腐蚀 | |
| C. |  图中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 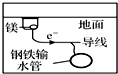 图中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com