
 CH3OH(g) ��H =-181.6kJ��mol-1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OH(g) ��H =-181.6kJ��mol-1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L��1�� | 0.2 | 0.1 | 0.4 |
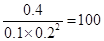 ��160�����Է�Ӧ������Ӧ������У�������Ӧ���ʴ����淴Ӧ���ʡ�
��160�����Է�Ӧ������Ӧ������У�������Ӧ���ʴ����淴Ӧ���ʡ�


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cC(g)���÷�Ӧ�ﵽƽ����A�����Ũ��Ϊ0.5mol/L���ں����½��ܱ���������ԭ����2�����ٴδﵽƽ����A��Ũ��Ϊ0.3mol/L��������������ȷ����
cC(g)���÷�Ӧ�ﵽƽ����A�����Ũ��Ϊ0.5mol/L���ں����½��ܱ���������ԭ����2�����ٴδﵽƽ����A��Ũ��Ϊ0.3mol/L��������������ȷ����| A��ƽ��������Ӧ�����ƶ� | B��a + b < c |
| C��B��ת������� | D��C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ���ֱ�Ϊ��H��K, ����ͬ�¶�ʱ��Ӧ4NH3��g��
2NH3��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ���ֱ�Ϊ��H��K, ����ͬ�¶�ʱ��Ӧ4NH3��g�� 2N2��g����6H2��g����Ӧ�Ⱥͻ�ѧƽ�ⳣ��Ϊ( )
2N2��g����6H2��g����Ӧ�Ⱥͻ�ѧƽ�ⳣ��Ϊ( )| A��2��H��2K | B��-2��H�� K2 |
| C��-2��H�� K-2 | D��2��H��-2K |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
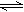 [Cu(NH3)3] Ac��CO������H��0��
[Cu(NH3)3] Ac��CO������H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
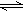 2C��g����D��g������x��һ����Χ�ڱ仯ʱ��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ��Ӧ�ﵽƽ��ʱ�������������������ʵ���Ϊ5mol����ʹ��ʼ��Ӧ������Ӧ������У���x��ȡֵ��Χ�����ʺϵ��ǣ� ��
2C��g����D��g������x��һ����Χ�ڱ仯ʱ��������ͨ�����ڷ�Ӧ�����¶ȣ�ʹ��Ӧ�ﵽƽ��ʱ�������������������ʵ���Ϊ5mol����ʹ��ʼ��Ӧ������Ӧ������У���x��ȡֵ��Χ�����ʺϵ��ǣ� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g������H<0������Ӧ�ﵽƽ��ı�һ��������x�����±�������y��һ��������ͼ�����ߵ���
2C��g������H<0������Ӧ�ﵽƽ��ı�һ��������x�����±�������y��һ��������ͼ�����ߵ���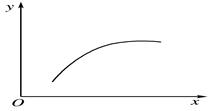
| | x | y |
| A | �¶� | ��������ƽ����Է������� |
| B | ѹǿ | A�İٷֺ��� |
| C | ��ͨ��A | B��ת���� |
| D | ������� | A���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC��g���ﵽƽ������¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1��9��������˵������ȷ����
pC��g���ﵽƽ������¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1��9��������˵������ȷ����| A��m+n��p | B��ƽ��������Ӧ�����ƶ� |
| C��A��ת���ʽ��� | D��C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C������+��X D��������5min�ﵽƽ�⣬��ʱ����CΪ2mol���ⶨD��ƽ����Ӧ����Ϊ0.1mol/L?min������˵���д������ �� ��
2C������+��X D��������5min�ﵽƽ�⣬��ʱ����CΪ2mol���ⶨD��ƽ����Ӧ����Ϊ0.1mol/L?min������˵���д������ �� ��| A��x = 2 |
| B��B��ת����Ϊ20% |
| C��ƽ��ʱA��Ũ��Ϊ0.75mol/L |
| D�����´�ƽ��ʱ������ѹǿΪ��ʼʱ��85% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������500��ʱ����2molN2��2molH2�����ݻ�Ϊ10L���ܱ������н��з�Ӧ���ﵽƽ��ʱ��NH3�����ܴﵽ��Ũ���ǣ� ��
2NH3��g������500��ʱ����2molN2��2molH2�����ݻ�Ϊ10L���ܱ������н��з�Ӧ���ﵽƽ��ʱ��NH3�����ܴﵽ��Ũ���ǣ� ��| A��0.01mol��L��1 | B��0.02mol��L��1 |
| C��0.05mol��L��1 | D��0.15mol��L��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com