
|
下面的实验中没有白色沉淀或晶体析出的是 | |
| [ ] | |
A. |
饱和石灰水中加入少量固体烧碱 |
B. |
饱和碳酸钠溶液中通入足量二氧化碳 |
C. |
氯化钙溶液中通入二氧化碳 |
D. |
硫酸氢钠溶液中加入氯化钡溶液 |
科目:高中化学 来源: 题型:阅读理解
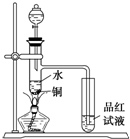 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:| 126b |
| 233a |
| 126b |
| 233a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修5 4.1卤代烃练习卷(解析版) 题型:实验题
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是ag/cm3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:①准确量取该卤代烷6 mL,放入锥形瓶中。②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。③反应完成后,冷却溶液,加稀HNO3酸化,滴加AgNO3溶液,得白色沉淀。④过滤、洗涤、干燥后称重,得到cg固体。
完成下面问题:
(1)装置中长玻璃管的作用是_________________。
(2)步骤④中,洗涤的目的是为了除去沉淀物上吸附的____________离子。
(3)该卤代烷中所含卤素的名称是_________,判断的依据是________________________。
(4)该卤代烷的相对分子质量是____________ (列出算式)。
(5)如果在步骤③中加入HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值(填下列选项代码) ____________。
A.偏大 B.偏小
C.不变 D.大小不定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com