
| A. | 每消耗l mol CH4可以向外电路提供8 mol e- | |
| B. | 负极上CH4失去电子,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| C. | 电池放电时,正极附近的pH不断降低 | |
| D. | 电池放电时,溶液中的OH-向正极移动 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.
解答 解:A、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,每消耗1molCH4可以向外电路提供8mole-;故A正确;
B、通入CH4的电极为负极失电子反应氧化反应,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故B正确;
C、通入氧气的一极为原电池的正极,得到电子发生还原反应:O2+2H2O+4e-=4OH-,所以正极附近的pH不断升高,故C错误;
D、电池反应时阳离子向正极移动,阴离子向负极移动,所以OH-向负极移动,故D错误;
故选AB.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.


科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H2 C2H6 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示溴化氢的形成过程为: | |
| B. | 海水中Br-的电子式为: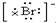 | |
| C. | 海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl | |
| D. | 氯离子的结构示意图为: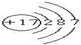 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷与氯气在光照的作用下的反应 | B. | 乙烯与溴的四氯化溶液的反应 | ||
| C. | 乙烯与水的反应 | D. | 乙烯自身生成聚乙烯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

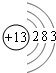 ,它的单质能(填能或不能)与氢氧化钠溶液反应.
,它的单质能(填能或不能)与氢氧化钠溶液反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com