
| A. | 稀氨水和Al2(SO4)3 | B. | 稀盐酸和Na2CO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
分析 只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别.
解答 解:A.无论是Al2(SO4)3溶液滴加到NH3•H2O溶液中还是NH3•H2O溶液滴加到Al2(SO4)3溶液中,都产生沉淀,不能鉴别,故A不选;
B.将碳酸钠溶液滴加到盐酸溶液中立即有气泡生成,将盐酸溶液滴加到碳酸钠溶液中,先没有气体生成,当盐酸滴加到一定程度后后气体生成,反应现象不同,可以鉴别,故B选;
C.无论是CaCl2溶液滴加到Na2CO3溶液中还是Na2CO3溶液滴加到CaCl2溶液中,都产生沉淀,不能鉴别,故C不选;
D.无论是Ba(OH)2溶液滴加到NaHSO4溶液中还是NaHSO4溶液滴加到Ba(OH)2溶液中,都产生沉淀,不能鉴别,故D不选.
故选B.
点评 本题考查物质的鉴别,注意不加任何试剂的鉴别与反应时量有关,把握改变滴加顺序发生的反应及现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有③不能发生 | D. | 只有④不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
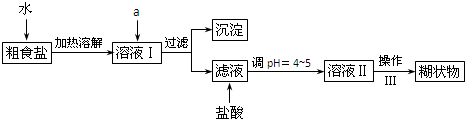
| 方案 质量 | 方案一 | 方案二 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种化学键 | |
| B. | 冰中存在氢键、液态氟化氢中不存在氢键 | |
| C. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | 氨气极易溶于水,重要的原因之一是由于氨分子与水分子之间能形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
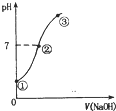 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HC1O的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(C1-)+c(ClO -) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
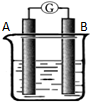 某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.
某研究性学习小组欲探究原电池的工作原理,按如图所示装置进行实验.| 序号 | A | B | 烧杯中的液体 |
| 1 | Mg | Al | 稀H2SO4 |
| 2 | Pt | Pt | NaOH溶液 |
| 3 | Pt | Pt | 熔融的Na2CO3 |
| 4 | Pb | PbO2 | 稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓解度:碳酸氢钠>碳酸钠 | |
| B. | 热稳定性:碳酸钠<碳酸氢钠 | |
| C. | 等质量时与足量酸反应产气量:碳酸钠>碳酸氢钠 | |
| D. | 一定的条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )
一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )| A. | 温度T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{{T}^{2}}}$ | |
| B. | 温度T℃时,混合气体的密度不变即达到平衡状态 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b改变的条件是温度,则该正反应放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com