
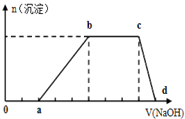
 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:

科目:高中化学 来源: 题型:
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA |
| C、1L 1.0mol?L-1 NH4Cl与2L 0.5mol?L-1 NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
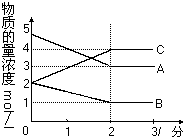 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏、石油的分馏都是物理变化 |
| B、工业上常用澄清石灰水和氯气反应制漂白粉 |
| C、蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D、二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B、pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C、在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) |
| D、0.1mol?L-1 NaHS溶液中:c(Na+)=c(HS-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com