
 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:科目:高中化学 来源:不详 题型:填空题
 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
 H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 可用于检测CO,反应原理为:
可用于检测CO,反应原理为:
 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量 ,并通人1molCO,CO2的体积分数
,并通人1molCO,CO2的体积分数 随时间的变化如下图所示。
随时间的变化如下图所示。
 _____________。
_____________。 的体积分数
的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。 为催化剂,可以将
为催化剂,可以将 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。 ______________。
______________。 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
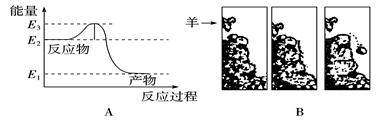
| A.E2 | B.E2-E1 | C.E3-E2 | D.E3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
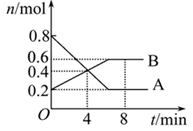
 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )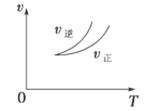
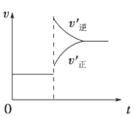
| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
 CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。| A.体系压强不再变化 | B.H2与CO的物质的量之比为1:1 |
| C.混合气体的密度保持不变 | D.气体平均相对分子质量为15,且保持不变 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。 2NO2(g)的△H= 。
2NO2(g)的△H= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
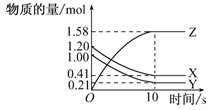
| A.从反应开始到10 s末,用Z表示的反应速率为0.158 mol/(L·s) |
| B.从反应开始到10 s末,用X表示的反应速率为0.79 mol/(L·s) |
| C.从反应开始到10 s末,Y的转化率为79.0% |
| D.该反应的化学方程式为X(g)+Y(g)=Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com