
已知: 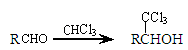 (-R表示烃基)
(-R表示烃基)
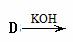 苯甲醇+苯甲酸钾
苯甲醇+苯甲酸钾
可由下列反应路线合成结晶玫瑰(只列出部分反应条件)
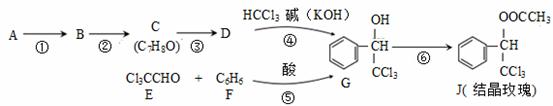
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的名称是 。
(2)C中的官能团是 。
(3)反应③的化学方程式为 。
(4)经反应路线④得到的副产物加水萃取、分液,能除去的副产物是 。
(5)已知: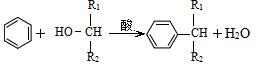 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为 。
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为 。
(6)G的同分异构体L遇FeCl3溶液显色,与足量饱和溴水反应未见白色沉淀产生,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为 (只写一种)。
(7)⑥的化学方程式是 。
(8)C有多种同分异构体,其中属于芳香族化合物的有 种(不包括C)。
【答案】
(1)甲苯 (2分)
(2)羟基 (2分)
(3) (2分)
(2分)
(4)苯甲酸钾 (1分)
(5) 1:2:4:4 (2分)
(6)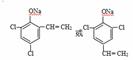 (2分)
(2分)
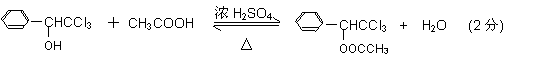
(7)
(8) 4 (2分)
【命题立意】本题考查有机物的结构和性质;
【解析】流程分析:采用逆向分析法,根据G、J的结构知反应⑥是G与乙酸的酯化反应,由反应条件可知,D到G发生了如信息提示中的反应,可推知D为苯甲醛(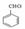 ),C的分子式为C7H8O,不饱和度为4,可知结构存在苯环和一个饱和C原子,可推知C为苯甲醇(
),C的分子式为C7H8O,不饱和度为4,可知结构存在苯环和一个饱和C原子,可推知C为苯甲醇(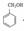 ),则C到D发生的是苯甲醇被氧化生成苯甲醛的反应,A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,设其分子式为CxHy,则有:12x+y=92,可推知,A的分子式为C7H8,不饱和度为4,对比A、C的结构可推知,A为甲苯(
),则C到D发生的是苯甲醇被氧化生成苯甲醛的反应,A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,设其分子式为CxHy,则有:12x+y=92,可推知,A的分子式为C7H8,不饱和度为4,对比A、C的结构可推知,A为甲苯( ),A到B发生的是甲基上的卤代反应,B到C发生的是卤代烃的水解生成苯甲醇;
),A到B发生的是甲基上的卤代反应,B到C发生的是卤代烃的水解生成苯甲醇;
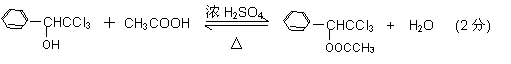 (1)由上述分析可知,A为甲苯;(2)C为苯甲醇(
(1)由上述分析可知,A为甲苯;(2)C为苯甲醇( ),官能团为羟基;(3)反应发生的是苯甲醇被氧化生成苯甲醛的反应,方程式为:
),官能团为羟基;(3)反应发生的是苯甲醇被氧化生成苯甲醛的反应,方程式为: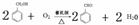 ;(4)由信息提示可知,D(
;(4)由信息提示可知,D( )
) 苯甲醇+苯甲酸钾,苯甲酸钾为可溶性的盐而其它物质不溶于水,则加水萃取、分液,能除去的副产物是苯甲酸钾;(5)根据提示信息
苯甲醇+苯甲酸钾,苯甲酸钾为可溶性的盐而其它物质不溶于水,则加水萃取、分液,能除去的副产物是苯甲酸钾;(5)根据提示信息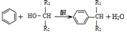 可知,反应⑤苯(
可知,反应⑤苯( )能与G(
)能与G(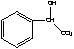 )反应生成
)反应生成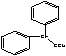 ,该有机物分子中含有4种位置不同的H,个数之比为1:2:4:4(苯环对称),氢原子数目之比就等于其吸收峰的面积之比,则各组吸收峰的面积之比为1:2:4:4;(6)根据遇FeCl3溶液显色可知L含酚羟基,与足量饱和溴水反应未见白色沉淀产生说明酚羟基的邻、对位被取代基取代,又L与NaOH的乙醇溶液共热说明L能发生消去反应,该基团是﹣C2H4Cl,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为
,该有机物分子中含有4种位置不同的H,个数之比为1:2:4:4(苯环对称),氢原子数目之比就等于其吸收峰的面积之比,则各组吸收峰的面积之比为1:2:4:4;(6)根据遇FeCl3溶液显色可知L含酚羟基,与足量饱和溴水反应未见白色沉淀产生说明酚羟基的邻、对位被取代基取代,又L与NaOH的乙醇溶液共热说明L能发生消去反应,该基团是﹣C2H4Cl,则L与NaOH的乙醇溶液共热,所得有机物的结构简式为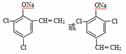 ;(7)根据G、J的结构知反应⑥是G与乙酸的酯化反应,方程式为:
;(7)根据G、J的结构知反应⑥是G与乙酸的酯化反应,方程式为:
(8)C为苯甲醇( ),属于芳香族化合物的同分异构体中,若苯环上取代基为(-CH3)和(-OH),有邻、间、对3种,若取代基(-OCH3)有一种,共有4种;
),属于芳香族化合物的同分异构体中,若苯环上取代基为(-CH3)和(-OH),有邻、间、对3种,若取代基(-OCH3)有一种,共有4种;


科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2,0.1 mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
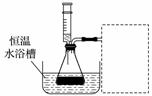
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:________________________________________________________________________。
②设计实验方案:在不同H2O2浓度下,测定________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成上图的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中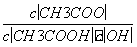 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.可利用废油脂制肥皂
B.袋装食品常用生石灰包作为食品的抗氧化剂
C.配制CuSO4溶液时加入少量的稀硫酸
D.用钠和钠的化合物做焰色反应实验,焰色均为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业上可利用“甲烷蒸气转化法”生产氢气,反应为甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,有关反应的能量变化如图1:
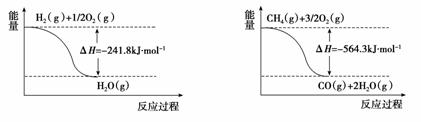
图1
则该反应的热化学方程式_____________________________________。
(2)已知温度、压强对甲烷平衡含量的影响如图2,请回答:
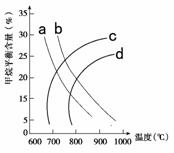
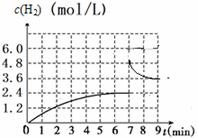
图2 图3
①图26-2中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②该反应的平衡常数:600 ℃时________700 ℃(填“>”“<”或“=”)。
③已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图3),此时CH4的转化率为________________,该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
④从图3分析,由第一次平衡到第二次平衡,平衡移动的方向是_____________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中铵根离子浓度逐渐增大。写出该电池的正极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜
B.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
 b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
c.晶体的熔点:金刚石<石墨
d.晶体中共价键的键角:金刚石>石墨
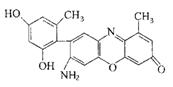
(2)某石蕊的分子结构如右图所示。
①石蕊分子所含元素中,第一电离能由小到大的顺序是 ,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2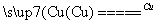 NF3+3NH4F
NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体,
②NF3与NH3均为三角锥形,但前者键角小于后者,原因是
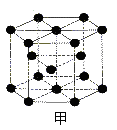 ③周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有 个该元素,金属铜采取如图乙所示堆积方式,可称为____ 堆积。
③周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有 个该元素,金属铜采取如图乙所示堆积方式,可称为____ 堆积。

乙
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼是一种新合成的无机材料,它是一种超硬耐磨、耐高温、抗腐蚀的物质。下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间的作用力类型相同的是( )
A.硫酸钠和金刚石 B.晶体硅和水晶
C.冰和干冰 D.苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的钢铁腐蚀中,下列说法正确的是( )
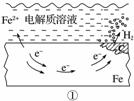
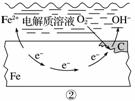
A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e-+2H2O===4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com