
(共12分)
醛类是重要的有机物。
47.松柏醇臭氧化反应生成的B含有醛基。

写出结构简式:B ;A 。
48.已知:
②醛甲+醛乙 醇+羧酸(歧化反应,简单的醛被氧化)
醇+羧酸(歧化反应,简单的醛被氧化)
醛基旁边的碳原子上的H原子叫α-H原子,比较活泼。制备季戊四醇的反应“流程”如下:

(1)写结构简式:D ;季戊四醇 。
(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂, 试简述其可做洗涤剂的结构原因 。
(3)实际生产中甲醛过量,原因是 。
49.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体有以下特点:
①有邻位的2个取代基;②遇氯化铁溶液呈紫色;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该内酯的结构简式为 。
50.环己酮中α-H也比较活泼,能发生以下反应:
 则E的结构简式为 。
则E的结构简式为 。
(本题共12分)47. HO-CH2CHO(2分) (2分)
(2分)
48.(1)C(CH2OH)3CHO (1分) C(CH2OH)4 (1分)
(2)有亲油基团(C12H25—),有亲水基团(—OH)(2分)
(3)提高乙醛的转化率或甲醛与甲醛可能发生歧化反应(1分,答一点即可)
49. (2分) 50.
(2分) 50. (1分)
(1分)
【解析】
试题分析:47.根据题意及物质反应的条件及产物可知B是HO-CH2CHO;A是 。
。
48.(1)由于在碱性条件下醛与醛发生反应时简单的醛被氧化,复杂的醛被还原,所以 与HCHO在碱性条件下发生反应,根据物质之间的转化关系可得D结构简式是:
与HCHO在碱性条件下发生反应,根据物质之间的转化关系可得D结构简式是: ;D与HCHO再发生反应得到
;D与HCHO再发生反应得到 ;(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂,其可做洗涤剂的结构原因该物质的分子中含有有亲油基团(C12H25—),有亲水基团(—OH),因此有很好的去污效果,可以作去污剂;(3)实际生产中甲醛过量,原因是增大甲醛的浓度可以提高乙醛的转化率,因为有以部分甲醛可能会发生甲醛与甲醛的歧化反应,为防止由于减小甲醛的减少而对产物的产率的影响,应该适当增加甲醛的量;
;(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂,其可做洗涤剂的结构原因该物质的分子中含有有亲油基团(C12H25—),有亲水基团(—OH),因此有很好的去污效果,可以作去污剂;(3)实际生产中甲醛过量,原因是增大甲醛的浓度可以提高乙醛的转化率,因为有以部分甲醛可能会发生甲醛与甲醛的歧化反应,为防止由于减小甲醛的减少而对产物的产率的影响,应该适当增加甲醛的量;
49.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体可以发生酯交换反应,而且有以下特点:①有邻位的2个取代基;②遇氯化铁溶液呈紫色,说明含有酚羟基;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该同分异构体是 ,其发生酯交换形成的内酯的结构简式为
,其发生酯交换形成的内酯的结构简式为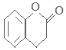
50.。根据已知条件及物质之间的转化关系可知E的结构简式是:
考点:考查有机物的结构、性质、转化、物质的结构简式及同分异构体的书写的知识。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2014-2015学年重庆市高高三第二次月考理综化学试卷(解析版) 题型:选择题
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍。Z是常见的金属,其原子的电子层数等于主族序数。W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.原子半径按X、Y、Z、R、W的顺序依次增大
B.WY2能与碱反应,但不能与任何酸反应
C.Z与Y形成的化合物可作为耐高温材料
D.熔沸点:X2R > X2Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省眉山市高三第一次诊断性考试理综化学试卷(解析版) 题型:实验题
(14分)以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O),其主要工艺流程如下:
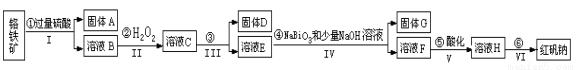
查阅资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr (OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式 。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
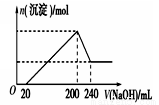
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为 ,固体D中含Fe化合物的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省眉山市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.12g金刚石晶体中含有的C—C的数目为2NA
B.1L 1 mol·L-1 AlCl3溶液中含有的Al3+数目为NA
C.在标况下,11.2L氯气通入足量的NaOH溶液中转移电子数为NA
D.常温常压下,22g CO2气体中含有的σ键和π键的数目均为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
A.电子层 B.电子亚层
C.电子云的伸展方向 D.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
A.H为-1价 B.熔融状态能导电 C.加热到600℃不分解
LiH的电子式为 。核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
共价键 | 键能(KJ/ mol) |
N≡N | 946 |
H-H | 436 |
H-N | 391 |
27.钯(Pd)是优良的储氢金属:2Pd (s)+xH2(g) 2PdHx (s)?H=-Q(Q>0)
2PdHx (s)?H=-Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx 产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
A.升温 B.减压 C.及时移走金属钯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
已知:红矾钾(K2Cr2O7)和红矾钠(Na2Cr2O7)的溶解度都随温度的升高而增大。根据溶解度差异,工业上用红矾钠、氯化钾制备红矾钾,反应原理为 Na2Cr2O7+ 2KCl→K2Cr2O7↓+2NaCl实验室模拟工业生产制备红矾钾时,合理的操作步骤是
A.称量、溶解、蒸发结晶、过滤、洗涤、干燥
B.称量、溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C.溶解、蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.溶解、蒸发结晶、过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:实验题
(12分)实验室利用下列装置可以准备FeCl3(加热、夹持装置和固定装置已略去)。圆底烧瓶中盛装KMnO4,分液漏斗中盛装浓盐酸,B中盛装纯铁粉。已知信息:① FeCl3的熔点为306℃,沸点为315℃。②FeCl3遇水蒸气会产生白雾。请回答下列问题:

(1)检查A装置气密性的操作方法是 。
(2)按气流由左向右流动的方向为A→( )→( )→( )→( )→( )相连进行实验。
(3)C装置的作用是 。
(4)用0.2mol的高锰酸钾固体和足量的浓盐酸完全反应后,得到标准状况下氯气的体积为11.2L,则含锰元素的生成物中锰元素的化合价为 。
(5)写出A装置中发生反应的化学方程式,并标出电子转移的方向和数目 。
(6)检验产品中是否含有FeCl2的实验方案为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:填空题
19.(10分)下表是不同温度下水的离子积数据:
温度 / ℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是____________。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=________
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com