
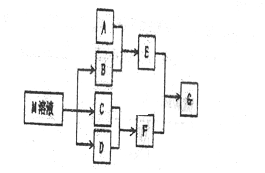
分析 (1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(2)B为NaOH,H、O、Na分别位于3个不同的周期,原子核外电子式数越多,原子半径越大;
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应得到G为H2SiO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解;
(5)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3;
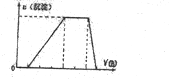
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系;
(7)若E可用于检验葡萄糖的存在,则E为氢氧化铜,E和F生成G,则G为氯化铜,由于铜离子能水解,氯化把易挥发,所以氯化铜溶液充分蒸发灼烧后的产物为氧化铜,氧化铜与乙醇发生氧化还原反应生成铜和乙醛.
解答 解:(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,用惰性电极电解M溶液的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)B为NaOH,H、O、Na分别位于3个不同的周期,原子核外电子式数越多,原子半径越大,原子半径大小顺序为Na>O>H,
故答案为:Na>O>H;
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以得到G为H2SiO3,
故答案为:H2SiO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失,
故答案为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失;
(5)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,可推知A中含有Fe2+,E为Fe(OH)3,G为FeCl3,则由A转化成E的离子方程式是:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓,
故答案为:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,
发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1积,
发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,
发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,
则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3;
(7)若E可用于检验葡萄糖的存在,则E为氢氧化铜,E和F生成G,则G为氯化铜,由于铜离子能水解,氯化把易挥发,所以氯化铜溶液充分蒸发灼烧后的产物为氧化铜,氧化铜与乙醇发生氧化还原反应生成铜和乙醛,反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,
故答案为:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
点评 本题考查无机物推断等,为高考常见题型,侧重考查学生的分析、计算能力,题目涉及元素化合物较多,需要学生全面掌握据基础知识,(6)中根据图象中的平台确定含有铵根离子是关键,注意离子方程式与电荷守恒的应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu+2 H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | 2Na+H2SO4═Na2 SO4+H2↑ | |
| C. | 3S+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2S+Na2SO3+3H2O | |
| D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将乙醇加入酸性重铬酸钾(K2Cr2O7)溶液中 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
| C | 将光亮的镁条放入NH4Cl溶液中 | 有大量气泡产生 | 反应生成H2和NH3 |
| D | 将NaAlO2溶液加入NaHCO3溶液中 | 有白色沉淀生成 | AlO2-结合H+的能力比HCO3-强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 | 4 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 25.35 | 24.05 | 23.95 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:2 | |
| C. | 反应中若有6molNO2参与反应,有4mol电子转移 | |
| D. | 反应中NO2是氧化剂,水是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 高锰酸钾溶液、SO2、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “暖冰”中的水分子存在π键 | |
| B. | 水变成“暖冰”,体积会变小 | |
| C. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” | |
| D. | -个水分子与其他水分子间只能形成2个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀HNO3中加入过量铁粉,再滴入少量KSCN溶液 | 溶液变红 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com