
| A. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
分析 A、氯气和水的反应为可逆反应;
B、标况下乙醇为液态;
C、16O2和18O2均为双原子分子;
D、在硫酸钠溶液中,阴离子除了硫酸根,还有氢氧根.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故A错误;
B、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、16O2和18O2均为双原子分子,故0.1mol混合物中含0.2mol氧原子即0.2NA个,与两者的比例无关,故C正确;
D、在硫酸钠溶液中,阴离子除了硫酸根,还有氢氧根,故溶液中阴离子所带的电荷数大于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2X<YH3<ZH4 | |
| B. | 最高价氧化物对应的水化物酸性:H2XO4>H3YO4>H2ZO3 | |
| C. | 元素的最高正化合价:X>Y>Z | |
| D. | 元素原子的半径:X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 喝不含杂质的纯净水比喝矿泉水对人体更营养、更健康 | |
| B. | 维生素C具有较强还原性,熟吃新鲜蔬菜维生素C损失小 | |
| C. | 波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害 | |
| D. | 亚硝酸钠具有强还原性而使肉类长时间保持鲜红,可在肉制食品中宜多加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
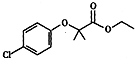
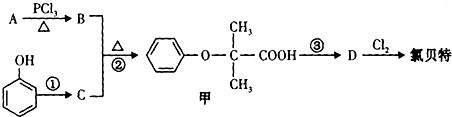
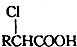

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
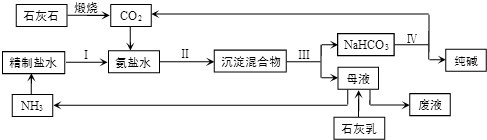
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com