
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
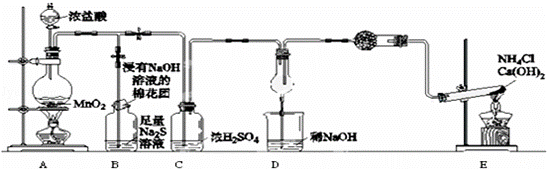
(1)写出A中反应的离子方程式 .
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 .
(3)浸有NaOH溶液的棉花团的作用是 .
(4)D中干燥管中出现的明显现象及化学方程式是 ; 8NH3+3Cl2=6NH4Cl+N2 .
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该洗气装置中盛装 试剂.
(6)还有什么方法能证明氧化性Cl2>S,(用化学方程式表示) .
考点: 性质实验方案的设计.
分析: 非金属性强弱比较的一般规律是:①根据氧化还原反应判断:同一化学反应,氧化剂的氧化性强于氧化产物的氧化性;②由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.③由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).④非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证.
为验证非金属元素氯的氧化性强于硫,该实验通过氯气把硫化钠溶液中的硫离子氧化为S单质说明,为验证非金属元素氯的氧化性强于氮,通过氯气能把氨气氧化生成氮气和氯化氢说明,实验装置中,A制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,浓盐酸易挥发,经过浓硫酸干燥的氯气中扔混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢,需要在C之前加装洗气装置,为该实验装置设计缺陷,B装置为为验证非金属元素氯的氧化性强于硫,B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性,反应为:Cl2+S2﹣=S↓+2Cl﹣,装置C进行干燥氯气,盛放氢氧化钠的烧杯吸收尾气,装置E为:氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
MnCl2+Cl2↑+2H2O,浓盐酸易挥发,经过浓硫酸干燥的氯气中扔混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢,需要在C之前加装洗气装置,为该实验装置设计缺陷,B装置为为验证非金属元素氯的氧化性强于硫,B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性,反应为:Cl2+S2﹣=S↓+2Cl﹣,装置C进行干燥氯气,盛放氢氧化钠的烧杯吸收尾气,装置E为:氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2;装置D氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,验证非金属元素氯的氧化性强于氮.
2NH3↑+2H2O+CaCl2;装置D氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,验证非金属元素氯的氧化性强于氮.
(1)此反应装置为浓盐酸和二氧化锰共热制备氯气,以此写出化学方程式;
(2)B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性;
(3)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气;
(4)装置E为实验室制取氨气的装置,氯气能把氨气氧化生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵,故现象为冒白烟;
(5)浓盐酸易挥发,经过浓硫酸干燥的氯气中仍混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢;
(6)依据非金属性强弱比较的一般规律进行验证.
解答: 解:(1)反应装置A为浓盐酸和二氧化锰共热制备氯气的装置,其离子方程式为:MnO2+4H++2Cl Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2﹣=S↓+2Cl﹣,
故答案为:Cl2+S2﹣=S↓+2Cl﹣;
(3)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气,反应为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:吸收多余的氯气;
(4)通E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此实验的现象是产生大量白烟,反应的方程式是8NH3+3Cl2=6NH4Cl+N2,
故答案为:产生大量白烟;8NH3+3Cl2=6NH4Cl+N2;
(5)盐酸易挥发,所以生成氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接一盛有饱和食盐水的装置以除去氯化氢气体,装置图为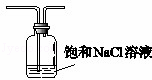 ,
,
故答案为:氯化钠;
(6)非金属性强弱比较的一般规律是:①由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.②由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).③非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证,所以还可用以下方法能证明氧化性Cl2>S,方法一:2Fe+3Cl2 2FeCl3、Fe+S
2FeCl3、Fe+S FeS;方法二:相同温度下相同状态的HCl的稳定性大于H2S;方法三:最高价氧化物对应的水化物的酸性HClO4 大于H2SO4.用化学方程式表示选择方法一,
FeS;方法二:相同温度下相同状态的HCl的稳定性大于H2S;方法三:最高价氧化物对应的水化物的酸性HClO4 大于H2SO4.用化学方程式表示选择方法一,
故答案为:2Fe+3Cl2 2FeCl3、Fe+S
2FeCl3、Fe+S FeS.
FeS.
点评: 本题考查实验方案的设计与评价,考查了氯气、氨气的实验室制法及性质的检验,明确制备原理及物质的性质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.某元素从化合态变成游离态,该元素一定被还原
C.由同种分子构成的物质一定是纯净物
D.电离时能生成H+的化合物一定是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
比较下列各组物质的沸点 ①丙烷<乙醇②正戊烷<异戊烷 ③1﹣丁烯<1﹣庚烯④乙二醇<丙三醇,其中正确的是( )
A.①②③ B.①③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A可用作果实催熟剂,某同学欲以A为主要原符合成乙酸已酯,其合成路线如图所示.
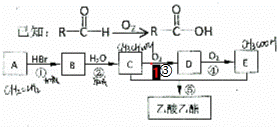
请回答:
(1)E的结构简式是 ,B分子中含有的官能团名称是 .
(2)反应①~⑤中反应类型与 相同的是 (填序号),B转化成A的反应条件是 .
(3)由A可以直接转化为C,其反应的化学方程式是 .
(4)反应③的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 若生成1 mol HNO3,则转移2mol电子
C. 还原剂和氧化剂的物质的量之比是2:1
D. 每消耗0.2 mol氧化剂,可收集到5.418L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后 ( )
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层几乎无色,下层为紫红色 D.下层无色,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4LH2O含有的分子数为 NA
B.通常状况下,NA 个CO2分子占有的体积为22.4L
C.物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
取1.43g Na2CO3·xH2O溶于水配成100ml溶液,取1.43g Na2CO3·xH2O晶体加热灼烧至恒重后质量为0.530 g求:x= (要求写出计算过程)(1)Na2CO3物质的量浓度;(2)Na+ 物质的量浓度; (3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.
请填写下列空白:
(1)A的化学式是 ;
(2)收集气体B的方法是 ;
(3)B与C两气体相遇时,可观察到的现象是 ;
(4)A与浓NaOH溶液共热时,发生反应的离子方程式是 .
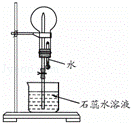
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com