
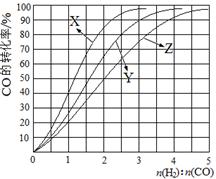
|
 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题: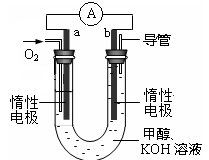
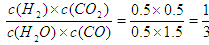 <1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。
<1,所以反应向正反应方向移动,即正反应速率大于逆反应速率。

科目:高中化学 来源:不详 题型:单选题
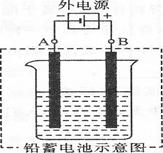
| A.铅蓄电池在放电过程中,正负极质量均增加 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释,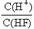 的值始终保持增大 的值始终保持增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
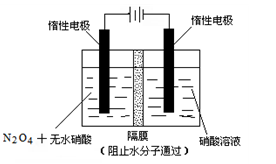
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
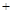 CO(g)
CO(g) CH3OH(g)
CH3OH(g)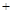 90.8 kJ
90.8 kJ CH3OCH3(g)
CH3OCH3(g)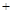 H2O(g)
H2O(g)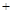 23.5 kJ
23.5 kJ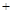 H2O(g)
H2O(g) CO2(g)
CO2(g)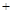 H2(g)
H2(g)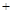 41.3 kJ
41.3 kJ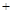 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g)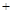 CO2(g)
CO2(g)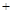 Q,其中Q
Q,其中Q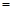 kJ;
kJ; CH3OCH3(g)
CH3OCH3(g)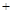 H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L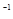 ) ) | 0.44 | 0.6 | 0.6 |
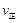 (甲醇)
(甲醇) 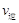 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。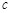 (CH3OH)
(CH3OH)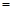 ;
;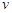 (CH3OH)
(CH3OH)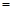 ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
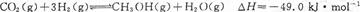
| A.O~1 min | B.1~3 min | C.3~8 min | D.8~11 min |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”)
2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2) v逆(N2)(填 “>” 、“="”" 或 “<”) 浓度mol.L-1 浓度mol.L-1时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。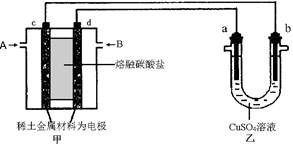
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入醋酸钠 | B.加入ZnCl2 | C.加入铜粉 | D.加入硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2+2CO2。
N2+2CO2。 N2(g)+2CO2(g)反应的平衡常数的表达式为:
N2(g)+2CO2(g)反应的平衡常数的表达式为: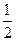 O2(g)=2CO2(g) △H=一283 kJ/mol
O2(g)=2CO2(g) △H=一283 kJ/mol N2(g)+2CO2(g)△H= kJ/mol。
N2(g)+2CO2(g)△H= kJ/mol。 N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。
N2(g)+2CO2(g),结合(2)中信息,下列说法正确的是 。 出行
出行查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com