
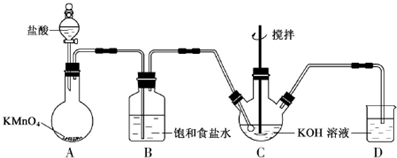
分析 根据实验装置图可知,在A中用高锰酸钾与浓盐酸制得氯气,氯气中有挥发的氯化氢在B装置中用饱和食盐水除去,氯得的氯气通入氢氧化钾溶液中搅拌,生成次氯酸钾,实验中氯气尾气在D装置中用氢氧化钾溶液吸收,
(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,配平书写离子方程式;
由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,应降低通入氯气的速率;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
(4)用砂芯漏斗过滤,除去氢氧化铁,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤,用乙醇洗涤,减少因溶解导致晶体损失,最后在真空干燥箱中干燥.
解答 解:(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
由于盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;HCl;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,缓慢滴加盐酸,减慢生成氯气的速率,
故答案为:缓慢滴加盐酸、装置C用冰水浴中;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中,
故答案为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中;
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥,
故答案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥.
点评 本题考查实验制备方案、氧化还原反应、物质的分离提纯、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.0mol | B. | 2.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素金属性:Z>W | |
| B. | X与Y可形成多种共价化合物 | |
| C. | 化合物Z2Y2中既含离子键,又含共价键 | |
| D. | Y元素只能形成一种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠盐 | B. | 钾盐 | C. | 铁盐 | D. | 钙盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
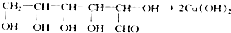 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$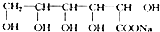 +Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
+Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com