
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)![]() 的中心原子价层孤电子对数目为______,一个
的中心原子价层孤电子对数目为______,一个![]() 离子中含有_______个
离子中含有_______个![]() 键;
键;
(3)![]() 巯基烟酸氧钒配合物
巯基烟酸氧钒配合物![]() 图
图![]() 是副作用小的有效调节血糖的新型药物。
是副作用小的有效调节血糖的新型药物。
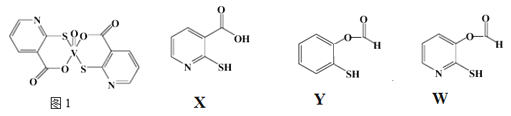
①该药物中N原子的杂化方式是_______;
②![]() 、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的原子个数和电子数,如苯分子中大
键的原子个数和电子数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
③下列微粒中存在“离域![]() 键”的是_____;
键”的是_____;
![]()
![]()
![]()
![]()
④![]() 分子中大
分子中大![]() 键可以表示为_______________;
键可以表示为_______________;
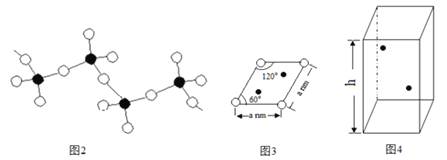
(5)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(6)某六方硫钒化合物晶体的晶胞如图4所示![]()
![]() 表示V,
表示V,![]() 表示
表示![]() ,该晶胞的化学式为VS。图3为该晶胞的俯视图。
,该晶胞的化学式为VS。图3为该晶胞的俯视图。
①请在图4中用![]() 标出V原子的位置;__________
标出V原子的位置;__________
②已知晶胞的密度为![]() ,计算晶胞参数
,计算晶胞参数![]() ____________cm。
____________cm。![]() 列出计算式即可
列出计算式即可![]()
【答案】
![]() 4
4 ![]()
![]() X中含有羧基可以与水分子形成氢键,增强水溶性;Y中含有酯基和苯环,W中含有酯基,都不利于水的溶解
X中含有羧基可以与水分子形成氢键,增强水溶性;Y中含有酯基和苯环,W中含有酯基,都不利于水的溶解 ![]()
![]()
![]() 八个顶点各一个,四条棱上各一个
八个顶点各一个,四条棱上各一个 ![]()
【解析】
(1)基态钒原子核外23个电子,根据构造原理书写其核外电子排布式;
(2)VO43-的中心原子价层孤电子对数目=![]() (5+3-4×2),一个VO43-离子中V原子和每个O原子形成一个共价单键,共价单键为σ键;
(5+3-4×2),一个VO43-离子中V原子和每个O原子形成一个共价单键,共价单键为σ键;
(3)①该药物中每个N原子含有一个孤电子对,两个σ键,根据杂化轨道理论确定其杂化类型;
②-COOH、-SH、氨基是亲水基,酯基是憎水基,亲水基个数越多其溶解性越大;
③形成离域π键的形成条件是“原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动“,硫酸根离子是正四面体结构,硫化氢中H原子和S原子没有平行的p轨道;
④CS2分子中大π键由3个原子形成的,且每个S原子提供1个p电子、C原子提供2个p电子;
(4)根据图知,每个V原子连接O原子个数=2+2×![]() =3,则偏钒酸根离子为VO3-;
=3,则偏钒酸根离子为VO3-;
(5)①根据图知,每个晶胞中含有2个S原子,其化学式为VS,则每个晶胞中含有2个V原子,每个顶点上含有1个V原子,要使每个晶胞中含有2个V原子,只能是竖着的每条棱上含有一个V原子;
②设其高为hcm,其体积V=(a×10-7 cm)×(a×10-7 cm)×sin60°×hcm,密度ρ=![]() 进行计算。
进行计算。
![]() 依据钒的原子序数是23可得,基态钒的原子结构示意图为:
依据钒的原子序数是23可得,基态钒的原子结构示意图为: ;
;
![]() 依据图1可知,
依据图1可知,![]() 的中心原子价层孤电子对数目为0,一个
的中心原子价层孤电子对数目为0,一个![]() 离子中含有4个
离子中含有4个![]() 键;
键;
![]() ①该药物中N原子形成了一个平面结构的环,因此杂化方式是:sp2;
①该药物中N原子形成了一个平面结构的环,因此杂化方式是:sp2;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为![]() ,原因是:羧基、N原子均能与水分子形成氢键,增大溶解度。X分子中既有羧基又含N原子,W分子中只含N原子,Y分子中既不含羧基,又不含N原子,故答案为:
,原因是:羧基、N原子均能与水分子形成氢键,增大溶解度。X分子中既有羧基又含N原子,W分子中只含N原子,Y分子中既不含羧基,又不含N原子,故答案为:![]() ;X中含有羧基可以与水分子形成氢键,增强水溶性;Y中含有酯基和苯环,W中含有酯基,都不利于在水中的溶解;
;X中含有羧基可以与水分子形成氢键,增强水溶性;Y中含有酯基和苯环,W中含有酯基,都不利于在水中的溶解;
③A.![]() 含有三中心四电子
含有三中心四电子![]() 键,故A正确;
键,故A正确;
B.![]() 的结构中没有离域
的结构中没有离域![]() 键,故B错误;
键,故B错误;
C.![]() 的结构中没有离域
的结构中没有离域![]() 键,故C错误;
键,故C错误;
D.![]() 含有三中心四电子
含有三中心四电子![]() 键,故D正确;
键,故D正确;
故答案为AD;
④CS2分子中大![]() 键可以表示为
键可以表示为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 根据图2所示推断偏钒酸铵的化学式为:NH4VO3;
根据图2所示推断偏钒酸铵的化学式为:NH4VO3;
![]() ①依据图3和图4可知,V原子所处的位置是:八个顶点各一个,四条棱上各一个,故答案为:八个顶点各一个,四条棱上各一个;
①依据图3和图4可知,V原子所处的位置是:八个顶点各一个,四条棱上各一个,故答案为:八个顶点各一个,四条棱上各一个;
②依据①的知识可知,晶胞中含有4个VS粒子,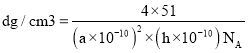 ,所以
,所以![]() ,故答案为:
,故答案为:![]() nm。
nm。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】如果阿伏加德罗常数的值为NA。下列说法正确的是( )
A.![]() 与
与![]() 所含的分子数一定相等
所含的分子数一定相等
B.将![]() 钠用铝箱包裹并刺小孔,与足量水充分反应生成H2分子数为
钠用铝箱包裹并刺小孔,与足量水充分反应生成H2分子数为![]()
C.![]() 与足量水反应转移
与足量水反应转移![]() 电子
电子
D.高温下,![]() 与足量水蒸气完全反应,转移的电子数为
与足量水蒸气完全反应,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下三氯化氮( NCl3)是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3的说法正确的是
A.分子中N—Cl键是非极性键
B.分子中不存在孤电子对
C.NCl3分子是极性分子
D.因N—Cl键的键能大,它的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)
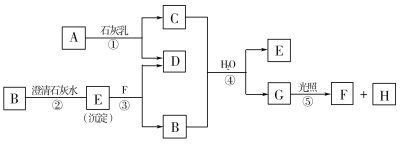
请回答以下问题:
(1)E是_____________,F是______________,H是_____________。(填化学式)
(2)C物质在日常生活中可作______________剂。
(3)写出反应①的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号 | 加入试剂 | 实验现象 |
Ⅰ | 4 mL 2 mol·L-1HCl 溶液 | 沉淀溶解 |
Ⅱ | 4 mL 2 mol·L-1NH4Cl 溶液 | 沉淀溶解 |
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程_____________。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因___________。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是_________。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是____________。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是___________。
③乙同学这样配制混合溶液的理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是( )
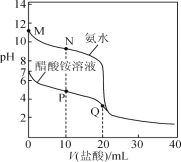
A.M点溶液中:c(OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中: c(NH4+)+c(NH3·H2O)<c(CH3COO-) +c(CH3COOH)
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
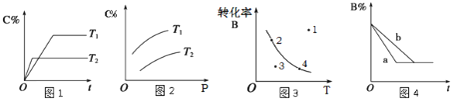
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com