
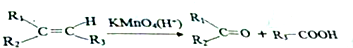
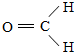 .
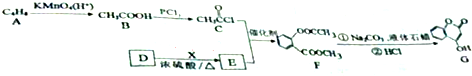
.分析 根据题中各物质转化关系,A氧化得B,根据信息Ⅰ,结合A的分子式及B的结构简式可知,A为CH3CH=CHCH3,B发生取代反应得C,根据F和C的结构简式可知,E为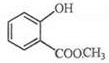 ,F变成G相当于在F分子中去掉1个X分子,比较F和G的结构简式可知,X为CH3OH,所以D为
,F变成G相当于在F分子中去掉1个X分子,比较F和G的结构简式可知,X为CH3OH,所以D为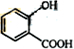 ,据此答题;
,据此答题;
解答 解:根据题中各物质转化关系,A氧化得B,根据信息Ⅰ,结合A的分子式及B的结构简式可知,A为CH3CH=CHCH3,B发生取代反应得C,根据F和C的结构简式可知,E为 ,F变成G相当于在F分子中去掉1个X分子,比较F和G的结构简式可知,X为CH3OH,所以D为
,F变成G相当于在F分子中去掉1个X分子,比较F和G的结构简式可知,X为CH3OH,所以D为 ,
,
(1)根据上面的分析可知,A为CH3CH=CHCH3,名称为2-丁烯,由B生成C的反应类型为取代反应,
故答案为:2-丁烯;取代反应;
(2)E为 ,E分子中的官能团名称为酯基和羟基,X为CH3OH,X催化氧化可生成一种常温下为气体的物质为HCHO,该气体分子的结构式为
,E分子中的官能团名称为酯基和羟基,X为CH3OH,X催化氧化可生成一种常温下为气体的物质为HCHO,该气体分子的结构式为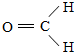 ,
,
故答案为:酯基和羟基;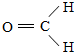 ;
;
(3)G分子的结构中存在苯环、羟基、碳碳双键,所以属于芳香族化合物,能够与溴单质发生加成反应或者取代反应,能够与金属钠反应产生氢气,G的分子式为C9H6O3,所以a、c、d、e正确;1molG中1mol碳碳双键和1mol苯环,所以需要4mol氢气,c错误,
故答案为:a、c、d、e.
点评 本题考查有机物的合成,题目难度中等,本题注意以A和E为推断该题的突破口进行解答,注意官能团的变化,把握题给信息.


科目:高中化学 来源: 题型:选择题
| A. | 冰箱中使用的含氟制冷剂泄露后,会增加空气中的PM2.5 | |
| B. | 节日焰火的五彩缤纷是某些金属单质性质的体现 | |
| C. | 施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 | |
| D. | 化学反应能够制造出新的物质,同时也能制造出新的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比纯铁容易生锈 | |
| B. | 钢铁的腐蚀生成疏松氧化膜,不能保护内层金属 | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e→4OH- | |
| D. | 为保护地下钢管不受腐蚀,可使其与直流电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| B. | 石英玻璃、陶瓷都属于硅酸盐产品 | |
| C. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| D. | 牛油和花生油在碱性条件下水解产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 | |
| B. | 利用化学反应可实现12C到14C的转化 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 气象环境报告中新增的“PM2.5”是对一种新分子的描述 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液再空气中失效:ClO-+CO2+H2O═HClO+HCO${\;}_{3}^{-}$ | |
| B. | 用浓盐酸与反应制取少量氯气MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通入过量的CO2制Al(OH)3 AlO2 -+CO2+2H2O=Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO${\;}_{4}^{2-}$+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com