
 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O, CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;  2NH3.
2NH3.

科目:高中化学 来源: 题型:
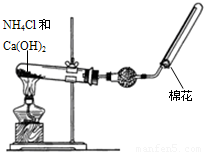
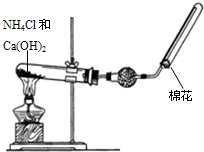 某同学在实验室用如图所示的实验装置制取并收集干燥的氨气.请回答下列问题.
某同学在实验室用如图所示的实验装置制取并收集干燥的氨气.请回答下列问题.
| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
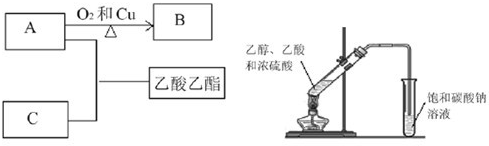
(15分)根据下图转化回答有关问题:
(1)① 写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
② B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
① 浓硫酸的作用是_______________ _______________。
② 饱和碳酸钠溶液的主要作用_______________。
③ 装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④ 若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤ 进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥ 生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源:2010-2011年山东省威海市高一下学期期末模块考试 题型:实验题
(15分)根据下图转化回答有关问题: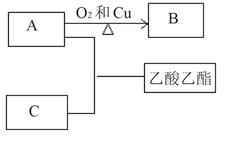
(1)①写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
②B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
①浓硫酸的作用是_______________ _______________。
②饱和碳酸钠溶液的主要作用_______________。
③装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
| A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水 |
| B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸 |
| C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸 |
| D.正反应的速率与逆反应的速率相等 |
查看答案和解析>>
科目:高中化学 来源:2010-2011年山东省威海市高一下学期期末模块考试 题型:实验题
(15分)根据下图转化回答有关问题:
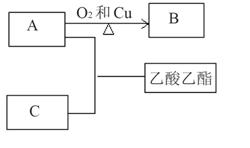
(1)① 写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
② B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
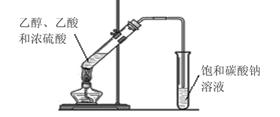
① 浓硫酸的作用是_______________ _______________。
② 饱和碳酸钠溶液的主要作用_______________。
③ 装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④ 若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤ 进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥ 生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com