
已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大。A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子。请回答下列问题:
(1)元素E在元素周 期表中的位置是 。
期表中的位置是 。
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为 ;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是 。
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有 (写出所有化合物,用化学式表示,下同),呈酸性的有  (写出所有化合物)。
(写出所有化合物)。
(4)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于氯水的叙述,不正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是O2
D.氯水放置后溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修3:物质结构与性质】(15分)
向盛有硫酸铜水溶液的试管里加入氮水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是_________________(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。与冰的晶体体类型相同的是________________(请用相应的编号填写)。
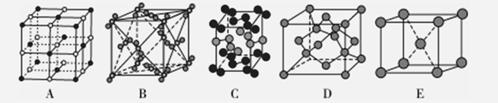
II.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。
(4)写出铜原子价电子层的电子排布式______________,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有____________________(填元素符号)。
(5)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有_______________.
(6)实验过程中加入C2H5OH后可观察到析出深蓝色[Cu(NH3)4]SO4·H2O晶体。实验中所加C2H5OH的作用是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有 X和
X和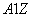 X+两种粒子,下列叙述正确的是 ( )
X+两种粒子,下列叙述正确的是 ( )
A.一定都是由质子、中子、电子组成的
B.化学性质几乎完全相同
C.质子数一定相等,质量数和中子数一定不相等
D.核电荷数和核外电子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,下列说法错误的是( )
| 电离能/kJ·mol-1 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11 |
A.元素X的常见化合价是+1价
 B.元素Y是第ⅢA族元素
B.元素Y是第ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,则它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如
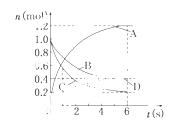 图所示,对该反应的推断合理的是 ( )
图所示,对该反应的推断合理的是 ( )
A.该反应的化学方程式为3B+4D 6A+2C
6A+2C
B.反应进行到1 s 时,v(A)=v(D)
时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
Fenton法常用于处理含难降解有机物的工业废水,通常 是在调节好pH和
是在调节好pH和
Fe2+浓度的 废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-
废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-
CP,探究有关因素对该降解反应速率的影响.
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下 表),设计如
表),设计如
下对比实验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 |
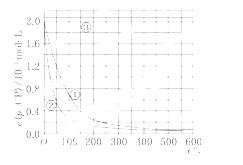
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图.
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:v(p-CP)=________mol/(L·s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________.
(4)实验③得出的结论是:pH等于10时,________.
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:_______________________
_______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:
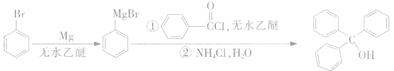
实验步骤如下:
①如图1所示,在三颈烧瓶中加入1.5 g镁屑,在滴液漏斗中加入6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。
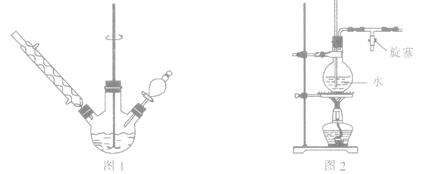
②继续加入3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加入30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、 ,抽滤优于普通过滤的显著特点是 。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是 。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com