
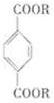
 某种对苯二甲酸酯常用作塑料增塑剂,其结构简式如图所示.(R表示相同的烃基)
某种对苯二甲酸酯常用作塑料增塑剂,其结构简式如图所示.(R表示相同的烃基)

| 16×4 |
| 23% |
| 278-64-12×8-1×4 |
| 2 |
 ,可推知B为
,可推知B为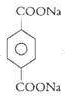 ,酸化得到D为
,酸化得到D为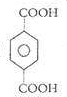 ,据此解答.
,据此解答.| 16×4 |
| 23% |
| 278-64-12×8-1×4 |
| 2 |
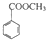 不是同系物关系,故D错误;
不是同系物关系,故D错误; ,可推知B为
,可推知B为 ,酸化得到D为
,酸化得到D为 ,
, ,
, ;
; +2NaHCO3→
+2NaHCO3→ +2CO2↑+2H2O;
+2CO2↑+2H2O;| Cu |
| △ |
 +2H2O,
+2H2O, +2NaHCO3→
+2NaHCO3→ +2CO2↑+2H2O;
+2CO2↑+2H2O;| Cu |
| △ |
 +2H2O;
+2H2O; ,苯环上只有1种H原子,故其一氯代物有1种,
,苯环上只有1种H原子,故其一氯代物有1种, 少一个羧基的化合物,N所有的同分异构体(含苯环),可以只有一个侧链为-COOH,可能有2个侧链为-OH、-CHO,有邻、间、对三种位置关系,故符合条件的同分异构体结构简式为:
少一个羧基的化合物,N所有的同分异构体(含苯环),可以只有一个侧链为-COOH,可能有2个侧链为-OH、-CHO,有邻、间、对三种位置关系,故符合条件的同分异构体结构简式为: ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氨水能被弱酸醋酸中和 |
| B、铵盐受热易分解 |
| C、氨水可以使酚酞试液变红 |
| D、常温下,0.1mol/L氯化铵溶液的pH约为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol/L的溶液 | X | Y | Z | W |
| PH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

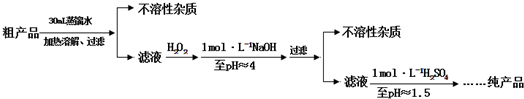

| 温 度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| CuSO4?5H2O | 23.1 | 32.0 | 46.4 | 61.8 | 83.8 |
| Cu(NO3)2?6H2O | 81.8 | 125.1 | |||
| Cu(NO3)2?3H2O | 160 | 178.5 | 208 |
查看答案和解析>>
科目:高中化学 来源: 题型:
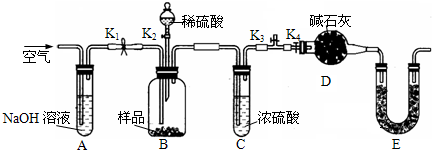
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g NO2含有NA个NO2分子 |
| B、10L pH=1的硫酸溶液中含有的H+离子数为2NA |
| C、标准状况下,NA个CO2分子所占的体积约为22.4 L |
| D、1mol Al3+离子含有的核外电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀会转变成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氯化铁溶液做腐蚀液制印刷电路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B、用醋酸除去暖瓶胆内水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、加入明矾后使浊水变清:Al3++3H2O=Al(OH)3↓+3H+ |
| D、碳酸氢钠溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com