
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |

分析 (1)①根据压强与气体物质的量成正比确定反应后气体的总物质的量;利用差量法计算出反应消耗乙苯的物质的量,然后计算出乙苯的转化率;
②利用三段式计算出平衡时各组分的物质的量,然后利用平衡常数表达式计算出该温度下该反应的平衡常数;
(2)该反应为气体体积增大的反应,减小压强后平衡向着气体体积增大的反应方向移动;再结合压强对反应速率的影响分析;
(3)①图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高;
②乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值;
③催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳.
解答 解:(1)①容器容积固定,则容器内压强与气体的总物质的量成正比,根据表中数据可知,达到平衡时压强为反应前的1.4倍,则平衡时气体的总物质的量为:amol×1.4=1.4amol;
平衡时气体的物质的量增大:1.4amol-amol=0.4amol,设有x mol 乙苯发生转化, △n
△n
1 1 1 1
xmol 0.4amol
则:x=$\frac{0.4amol×1}{1}$=0.4amol,
所以乙苯的转化率为:$\frac{0.4amol}{amol}$×100%=40%,
故答案为:1.4a;40%;
②发生反应为
反应前(mol) a 0 0
转化(mol) 0.4a 0.4a 0.4a
平衡时(mol) 0.6a 0.4a 0.4a
则该反应的平衡常数为:K=$\frac{\frac{0.4a}{V}×\frac{0.4a}{V}}{\frac{0.6a}{V}}$=$\frac{4a}{15V}$,
故答案为:$\frac{4a}{15V}$;
(2)根据反应方程式可知,该反应中气体的分子数增加,则减小压强后平衡右移,乙苯转化率增大,苯乙烯产率增加;减小压强后使乙苯浓度减小,则反应速率减小,
故答案为:该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小;
(3)①图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
②乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;
③催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳,反应的化学方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯酚能与溴水反应,苯不能与溴水反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯与溴蒸气(光照)发生取代反应,苯与液溴(铁做催化剂)发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
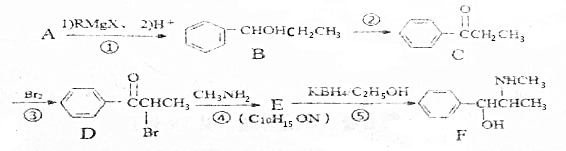
 (R、R′、R″均代表烃基;X代表卤素原子);
(R、R′、R″均代表烃基;X代表卤素原子); .
. .反应⑤的反应类型为还原反应.
.反应⑤的反应类型为还原反应. .
. (写反式结构)
(写反式结构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com