

| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
| 高温 |
| y |
| 2 |
| 高温 |
| y |
| 2 |
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.1×0.1 |
| 0.1×0.2 |
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.11×0.11 |
| 0.19×0.09 |
| 25 |
| 2 |
| 25 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、CuCl2 (CuO) |
| B、NaOH (NaOH) |
| C、CuSO4 (CuCO3) |
| D、NaCl (NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘在CCl4中的溶解度大于在水中的溶解度 |
| B、萃取后水层颜色变浅 |
| C、萃取后CCl4溶液层为紫红色 |
| D、萃取后水层颜色变红且在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
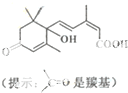 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、1 mol S-诱抗素的分子能与2molNaOH反应 |
| B、能发生加成、取代、消去反应 |
| C、S-诱抗素的分子式为C14H19O4 |
| D、含有碳碳双键、苯环、羟基、羰基、羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
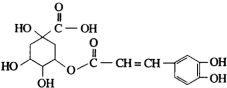 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与7molNaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
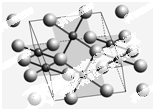 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、SO42-、Ba2+、Cl- |
| B、Ca2+、Na+、NO3-、CO32- |
| C、Cl-、H+、Na+、CO32- |
| D、Na+、NO3-、K+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com