



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、碳酸氢铵溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO3-+OH-═CO32-+H2O |
| B、25℃时,pH=8的0.1mol?L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| X | 它的一种核素的原子核内没有中子 |
| Y | 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z | 基态原子的最外层电子排布式为nsnnpn+1 |
| W | 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T | 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| 时间(min) | 0 | 2 | 4 | 6 | 8 |
| c(HI)mol?L-1 | 8.0 | 5.0 | 3.0 | 2.0 | 2.0 |
| c(H2)mol?L-1 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g?mol-l | 32 | 34 | / |
 ,则X的化学式为
,则X的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
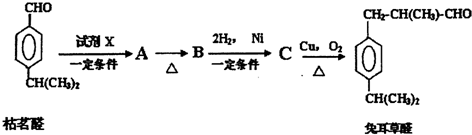


查看答案和解析>>
科目:高中化学 来源: 题型:
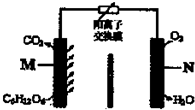 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com