
| A. | 非金属性:S>Si | B. | 离子半径:Na+>S2- | ||
| C. | 第一电离能:N>O | D. | 元素电负性:C>H |
分析 A、同周期自左而右元素的非金属性增强;
B、电子层数越多,离子半径越大;
C、氮元素的最外层电子排布为半充满状态,是一种稳定结构,所以氮的第一电离能要大于相邻的同周期元素;
D、非金属性越强,元素的电负性越大;
解答 解:A、同周期自左而右元素的非金属性增强,所以非金属性:S>Si,故A正确;
B、电子层数越多,离子半径越大,所以离子半径:Na+<S2-,故B错误;
C、氮元素的最外层电子排布为半充满状态,是一种稳定结构,所以氮的第一电离能要大于相邻的同周期元素,所以第一电离能:N>O,故C正确;
D、非金属性越强,元素的电负性越大,碳的非金属性强于氢,所以元素电负性:C>H,故D正确,
故选B.
点评 本题考查同周期同主族元素的性质递变规律等,难度中等,注意掌握金属性、非金属性的比较.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- | |
| B. | H2CO3的电离:H2CO3═2H++CO32- | |
| C. | 水溶液中的NaHCO3电离:NaHCO3═Na++HCO3- | |
| D. | 水溶液中的Fe(OH)3电离:Fe(OH)3═Fe3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
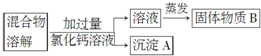
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{25}{2a}$ mol•L-1 | B. | $\frac{125}{2a}$mol•L-1 | C. | $\frac{125}{4a}$mol•L-1 | D. | $\frac{75}{2a}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键既影响物质的物理性质,也决定物质的稳定性 | |
| B. | 离子化合物的熔点一定比共价化合物的高 | |
| C. | 稀有气体形成的晶体属于分子晶体 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e+=Fe3+,继而形成铁锈 | |
| C. | 将水库中的水闸(钢板)与外加直流电源的负极相连接,正极连接到一个废铁上可防止水闸被腐蚀 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 化学反应的方向与反应的熵变无关 | |
| C. | 室温下,CaCO3(s)=CaO(s)+CO2(g)不能自发进行,说明该反应△H<0 | |
| D. | 同一物质:固体→液体→气体的变化是焓增和熵增的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是Zn和Cu形成的原电池,下列描述合理的是( )
如图是Zn和Cu形成的原电池,下列描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com