
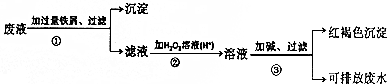
分析 (1)操作①加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把银离子和金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜过量的铁;
(2)步骤②是将Fe2+转化为Fe3+,发生氧化反应,所以应加氧化剂得电子;
(3)氯化铁中加入氨水生成氢氧化铁,离子反应方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
解答 解:(1)废液中含有Fe3+、Cu2+、Ag+三种金属离子,加入过量的铁粉后,银离子变成单质银、铜离子被还原成金属铜,所以在第①得到的沉淀中含有金属铜和过量的铁,
故答案为:银、铜、铁;
(2)步骤②是将Fe2+转化为Fe3+,发生氧化反应,所以应加氧化剂得电子,只有新制氯水,故选C;
(3)氯化铁中加入氨水生成氢氧化铁,离子反应方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
点评 本题考查了金属的回收与环境保护,题目难度中等,注意掌握金属回收方法、常见的离子之间的反应,明确离子方程式的书写方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | p(Ne)>p(N2)>p(O2) | B. | p(O2)>p(Ne)>p(N2) | C. | p(N2)>p(O2)>p(Ne) | D. | p(N2)>p(Ne)>p(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有强腐蚀性 | |
| B. | 能用于氯气、二氧化硫的干燥 | |
| C. | 可贮存在铁制容器中 | |
| D. | 可在盛有浓硫酸的烧杯中加水稀释成稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业用焦炭在高温下还原二氧化硅制得高纯硅 | |
| B. | SiO2可用于制造光导纤维 | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 氧化镁熔点高达250℃,是优质的耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子沿外电路从锌电极流向铜电极 | |
| C. | 氮氧燃料电池工作时,氮气在负极被氧化 | |
| D. | 原电池中一定发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲醚分子中既含有极性键又含有非极性键 | |
| B. | 二甲醚与乙醛是同分异构体 | |
| C. | 在二甲醚构成的燃料电池中,每消耗0.5mol二甲醚可以向外电路提供6 mol e- | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1455kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com