

分析 (1)Se元素34号元素,其核外电子的排布式为1s22s22p63s23p63d104s24p4;
(2)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即杂化轨道数目为4;
(3)键长越长,键能越小,化学键越不稳定,氢化物越容易电离;计算中心原子的价层电子对、孤电子对确定微粒构型;
(4)①硼酸结构式为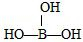 ,属于一元弱酸,说明硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成[B(OH)4]-与H+;
,属于一元弱酸,说明硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成[B(OH)4]-与H+;
②H3PO3是中强酸,非羟基氧原子数为1,含有2个羟基,属于二元酸;
(5)a位置S2-离子与b位置Zn2+离子位于晶胞体对角线上,黑色球到侧面距离均相等,过晶胞中左侧2个黑色球、右侧2个黑色球及面心白色球作左、右侧面的平行面,可以将体对角线4等份,即a位置S2-离子与b位置Zn2+离子的距离为晶胞体对角线的$\frac{1}{4}$.利用均摊法计算晶胞中Zn、S原子数目,进而计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积,计算晶胞棱长,进而计算晶胞体对角线.
解答 解:(1)Se元素34号元素,其核外电子的排布式为1s22s22p63s23p63d104s24p4,Se原子中电子占据的最高能层是N能层,该能层具有的原子轨道数为4,其核外M层电子的排布式为3s23p63d10,
故答案为:N;4;3s23p63d10;
(2)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,杂化轨道数目为4,因此S原子采用的杂化轨道方式为sp3,
故答案为:sp3;
(3)H-Se键长>H-S键长,故H-S键能更大,更稳定,在水中更难电离,H2Se的酸性比H2S强,
气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO42-中S形成4个δ键,孤电子对数为 $\frac{6+2-2×4}{2}$=0,则为正四面体,
故答案为:强;平面三角形;正四面体;
(4)①硼酸结构式为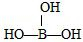 ,属于一元弱酸,说明硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成[B(OH)4]-与H+,其电离方程式为:H3BO3+H2O?[B(OH)4]-+H+,
,属于一元弱酸,说明硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成[B(OH)4]-与H+,其电离方程式为:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
②H3PO3是中强酸,非羟基氧原子数为1,含有2个羟基,属于二元酸,则1molH3PO3可以消耗2molNaOH,所以亚磷酸与过量的NaOH反应的化学方程式为:H2PO3+2NaOH=Na2HPO3+2H2O;
故答案为:H2PO3+2NaOH=Na2HPO3+2H2O;
(5)a位置S2-离子与b位置Zn2+离子位于晶胞体对角线上,黑色球到侧面距离均相等,过晶胞中左侧2个黑色球、右侧2个黑色球及面心白色球作左、右侧面的平行面,可以将体对角线4等份,即a位置S2-离子与b位置Zn2+离子的距离为晶胞体对角线的$\frac{1}{4}$.
该晶胞中S2-个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Zn2+个数=4,故晶胞质量为4×$\frac{97}{{N}_{A}}$g,ZnS的密度为d g•cm-3,则晶胞棱长=$\root{3}{\frac{4×\frac{97}{{N}_{A}}g}{dg.c{m}^{-3}}}$=$\root{3}{\frac{4×97}{d{N}_{A}}}$cm,则晶胞体对角线长度为$\sqrt{3}$×$\root{3}{\frac{4×97}{d{N}_{A}}}$cm,故a位置S2-离子与b位置Zn2+离子的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×97}{d{N}_{A}}}$cm=离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×97}{d{N}_{A}}}$×1010pm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×97}{d{N}_{A}}}$×1010.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、分子结构与性质、晶胞计算等,(5)中计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度中等.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子晶体 | B. | 分子晶体 | C. | 金属晶体 | D. | 以上均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物是多肽 | B. | 淀粉水解的最终产物是葡萄糖 | ||
| C. | 纤维素不能水解成葡萄糖 | D. | 油脂水解产物之一是乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑨⑩ | B. | ②④⑦⑨⑩ | C. | ③④⑦⑩ | D. | ④⑤⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸甲酯 | B. | 乙酸异丙酯 | C. | 麦芽糖 | D. | 蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C为固体,则B一定是气体 | B. | B和C一定都是气体 | ||
| C. | B和C可能都是固体 | D. | B和C不可能都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能大小:S>P>Si | |
| B. | 电负性顺序:C<N<O<F | |
| C. | 晶格能是气态离子形成1摩离子晶体释放的能量,晶格能越大,形成的离子晶体越稳定 | |
| D. | 由于N2和O22+互为等电子体,所以可以推断O22+的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作水果的催熟剂 | B. | SO2可用于杀菌消毒 | ||
| C. | 2H和3H可用于制造氢弹 | D. | 裂化汽油可用作萃取剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com