
【题目】决定化学反应速率的内因是
A. 温度 B. 浓度 C. 反应物的性质 D. 催化剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3 , 不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),设计了如下流程: 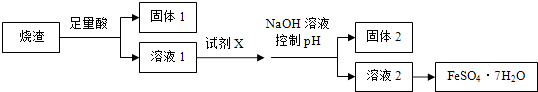 下列说法不正确的是( )
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2 , 控制pH是为了使Al3+转化为Al(OH)3 , 进入固体2
C.从溶液2得到FeSO47H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO47H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 . 已知该反应中H2O2只发生如下过程:H2O2→O2 . 请回答:
(1)该反应中的还原剂是;
(2)该反应中发生还原反应的是
(3)写出该反应的化学方程式,并标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是一种重要的有机化工原料,现以它为初始原料,设计如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物. 
已知有如下转换关系:
Ⅰ. ![]()
![]()
![]()
Ⅱ. ![]()
![]()
![]() (苯胺,易被氧气氧化)
(苯胺,易被氧气氧化)
回答下列问题:
(1)B分子中官能团名称是 . H分子为功能高分子,其链节组成为C7H5NO,反应④的类型是 .
(2)反应⑤的化学方程式是 .
(3)对于化合物1,下列说法不正确的是 .
A.能发生加成反应
B.能与金属 Na发生反应
C.与 E互为同系物
D.存在属于酯类的同分异构体
(4)F分子的结构简式 . 写出③的转化关系(用已知中的表达方式表示,不用写化学方程式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种优质的液体燃料,二甲醚与合成气制乙醇是目前合成乙醇的一种新途径,总反应为:CH3OCH3(g)+CO(g)+2H2 (g)CH3OH(g)+C2H5OH(g).向反应系统中同时通入二甲醚、一氧化碳和氢气,先生成中间产物乙酸甲酯后,继而生成乙醇.发生的主要化学反应有:
反应过程 | 化学方程式 | 不同温度下的K | ||
273.15K | 1000K | |||
Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)CH3COOCH3(g) | 1016.25 | 101.58 |
Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)CH3OH(g)+C2H5OH(g) | 103.97 | 10﹣0.35 |
回答下列问题:
(1)二甲醚碳基化反应的△H0 (填“>”“<”“=”).
(2)若反应在恒温恒容下进行,下列可说明反应已经达到平衡状态的是 .
A.2v(CH3COOCH3)=v(H2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中C2H5OH的体积分数保持不变
(3)总反应CH3OCH3(g)+CO(g)+2H2 (g)CH3OH(g)+C2H5OH(g)的平衡常数表达式K= , 随温度的升高,总反应的K将(填“增大”、“不变”或“减小”).
(4)在压强为1Mpa条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示.观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是 , 简要解释产生这种变化的原因 .
(5)将CH3OCH3(g)和CO(g)按物质的量之比1:1充入密闭容器中发生碳基化反应,在T K时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |
①20min时,只改变了某一条件,根据上表中的数据判断改变的条件可能是(填字母).
A.通入一定量的CO B.移出一定量的CH3OCH3C.加入合适的催化剂
②在图3中画出TK,CH3COOCH3(g)的体积分数随反应时间的变化曲线 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4) 是一种易分解、易水解的白色固体,某研究小组用如图1所示的实验装置,模拟工业原理用氢氧化钠晶体、浓氨水、干冰等作原料制备氨基甲酸铵.主要反应原理为:2NH3(g)+CO2(g)H2NCOONH4(s)△H<0 
(1)仪器1盛装的试剂是 . 仪器3的名称是 , 其中NaOH固体的作用是 .
(2)装置6(虚线方框内部分)的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该(填“加快”、“减慢”或“不改变)产生氨气的流速.
(3)另有一种传统制备氨基甲酸铵的反应器(CCl4充当惰性反应介质) 如下:
①写出氨基甲酸铵受热分解成尿素CO(NH2)2的方程式 .
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥可采取的方法是()
A.蒸馏 B.常压加热烘于 C.高压加热烘于 D.真空微热烘于
(4)实验中如图2发现用玻璃烧瓶做反应器,内壁容易形成致密坚硬、粘附能力强的产物结晶体.研究小组采用聚氯乙烯薄膜材料的反应器,优点是()
A.可避免产物粘附时内壁影响散热
B.可以揉搓方便收集产品
C.性质稳定
(5)氨基甲酸铵变质后会转化为碳酸氢铵.取1.173g变质后的样品,加入足量澄清石灰水,使样品中碳元素全部转化为碳酸钙,过滤、洗涤、干燥得到沉淀1.500g.该样品中氨基甲酸铵物质的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇发生的各种反应中,断键方式不正确的是( ) 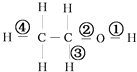
A.与钠反应①
B.在铜催化下加热①③
C.在浓硫酸170°C条件下加热②③
D.与HCl反应生成氯乙烷②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学. 某同学需要配制0.1molL﹣1 的NaHCO3溶液500mL,请根据溶液配制过程中的情况回答下列问题:
(1)NaHCO3的俗称;配制0.1molL﹣1 的NaHCO3溶液时,应称取固体NaHCO3的质量为 .
(2)实验中除了托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒外还需要的其它仪器有;其中两次用到玻璃棒,其作用分别是 .
(3)定容观察液面时俯视刻度线,所配溶液浓度(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com