
| A. | 质量数是60 | B. | 质子数是 27 | C. | 中子数是33 | D. | 电子数是33 |
科目:高中化学 来源: 题型:多选题
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | B. | c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | ||
| C. | c(C2O42-)>c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠是漂粉精的主要成分 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
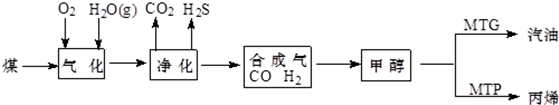
 .
.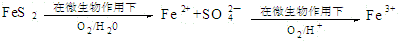
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
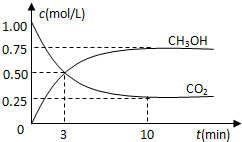 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 10分钟后容器中各物质浓度不再改变 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | Na2S04溶液 | AgN03溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积/滴 | 浓度/(mol•L-1) | ||
| ① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-1) | 稀释后Ag+浓度/(mol•L-1) | 混合液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.0l | 0.12 |
| ④ | 0.001 |
| 编号 | AgNO3溶液 浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com