
【题目】现用Na2SO4固体来配制480mL0.2mol·L-1的Na2SO4溶液。可供选择的仪器如图:
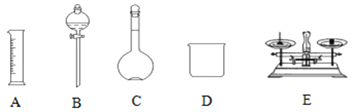
(1)如图所示的仪器中配制溶液不需要的是__ (填选项),配制上述溶液还需用到的玻璃仪器是___、__ (填仪器名称)。
(2)使用容量瓶之前必须进行的操作是___。(填选项)
A.检查气密性 B.检查是否漏水 C.烘干
(3)经计算,需Na2SO4的质量为___g。
(4)你选用的容量瓶规格为___mL。
(5)配制溶液时,一般可分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其操作顺序:②→__→__→__→__→__→__(填序号)。___
(6)在配制过程中,其他操作都准确,定容时俯视刻度线会使所配溶液浓度__(填“偏高”、“偏低”或“无影响”)。
【答案】B 胶头滴管 玻璃棒 B 14.2 500 ①③⑤⑥⑦④ 偏高
【解析】
(1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)容量瓶带有瓶塞,为防止使用过程中漏水,使用前应检查是否漏液;
(3)依据m=cVM计算;
(4)根据实验室常见容量瓶的规格选择;
(5)根据配制一定物质的量浓度溶液的操作步骤排序;
(6)定容时俯视刻度线,会导致溶液的体积偏小,据此分析判断。
(1)配制一定物质的量浓度的溶液的步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称取硫酸钠,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有托盘天平、玻璃棒、量筒、胶头滴管、小烧杯、500mL容量瓶,所以用不到的仪器有分液漏斗,还缺少的仪器:胶头滴管、玻璃棒,故答案为:B;胶头滴管;玻璃棒;
(2)容量瓶带有瓶塞,为防止使用过程中漏水,使用前应检查是否漏液,故答案为:B;
(3)实验室没有480mL的容量瓶,应该选用500 mL的容量瓶配制,Na2SO4的质量为0.5L×0.2mol/L×142g/mol=14.2g,故答案为:14.2;
(4)实验室没有480mL的容量瓶,应该选用500 mL的容量瓶配制,故答案为:500;
(5)配制一定物质的量浓度的溶液的步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以正确的操作顺序为②①③⑤⑥⑦④,故答案为:①③⑤⑥⑦④;
(6)在配制过程中,其他操作都准确,定容时俯视刻度线,导致溶液的体积偏小,会使所配溶液浓度偏高,故答案为:偏高。


科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
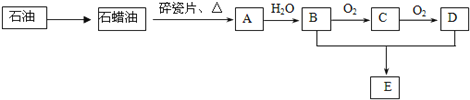
请回答下列问题:
(1)工业上,由石油获得石蜡油的方法是___________________。
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(—CH3),则这种同分异构体的结构简式是:___________________;D物质中官能团的名称是_______________。
(3)A、B共0.1 mol,完全燃烧消耗O2的体积是_______(标准状况下)。
(4)反应B→C的化学方程式为______________________。
(5)反应B+D→E的化学方程式为______________________;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26 届会议新修订了阿伏加德罗常数(NA=6.02214076×1023 mol―1), 并将于2019 年 5月20 日正式生效。下列说法中正确的是
A. 在 1 mol![]() 中,含有的中子数为 6 NA
中,含有的中子数为 6 NA
B. 将7.1 g C12溶于水制成饱和氯水,转移的电子数为 0.1 NA
C. 标准状况下,11.2 L NO和11. 2 L O2混合后,气体的分子总数为 0.75 NA
D. 某温度下,1L pH= 3的醋酸溶液稀释到10L 时,溶液中 H+的数目大于0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物,完成填空。
① C2H4 ② C2H2 ③ ![]() ④
④![]()
⑤ ![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧ 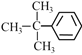 ⑨反-2-丁烯
⑨反-2-丁烯
(1)①~⑨中,属于苯的同系物的是____(填序号,下同);
(2)②的电子式为___________;
(3)④的系统命名为 ___________;
(4)⑨的结构简式为 __________;
(5)③被酸性KMnO4溶液氧化的有机产物的结构简式为_____和__________;
(6)⑧在核磁共振氢谱中有_______组峰;
(7)①、 ③、 ⑨的沸点由高到低的顺序是____________;
(8)写出⑤的含有苯环且与⑤不同类别的一种同分异构体的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据物质的量的相关公式,完成下列问题。(注意书写单位)
(1)3.01×1023个NH3分子的物质的量__。
(2)0.5molH2SO4含有的氧原子的物质的量__。
(3)2.3gNO2的物质的量__。
(4)标况下,33.6LN2的物质的量___。
(5)0.5mol /LK2SO4溶液中,c(K+)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
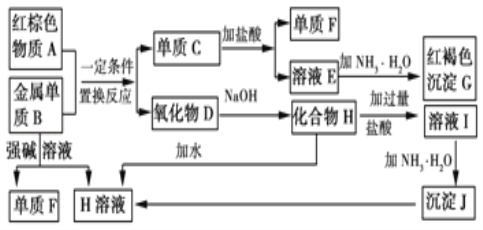
请回答下列问题:
(1)物质A的化学式为_____。
(2)写出单质B与强碱溶液反应的离子方程式_____,氧化物D与NaOH溶液反应的化学方程式_____。
(3)溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式_____。
(4)溶液E敞口放置容易变质,写出检验溶液E是否变质的实验操作、现象及结论_____。为了防止溶液E的变质,可往溶液中加入_____。用离子方程式说明______________
(5) 把3.06 g铝和镁的混合物粉末放入100 mL盐酸中,恰好完全反应,并得到标准状况下3.36 L H2。则该合金中铝的物质的量_____,反应后溶液中Cl-的物质的量浓度_____(假定反应体积仍为100 mL)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氯(Cl2O)是一种常用的氯化剂。常温下,Cl2O是棕黄色、有刺激性气味的气体,熔 点为-120.6°C,沸点为2.0°C,易与水反应生成次氯酸。实验室欲用氯气通入含水8%的碳酸钠固体中 制备并收集少量纯净的Cl2O,请用下列装置设计实验并探究相关物质的性质。
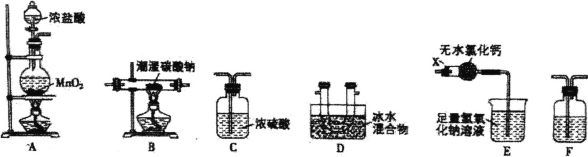
(1)装置E中仪器X的名称为 ______。
(2)装置的连接顺序是A __________(每个装置限用一次)。
(3)装置F中盛装试剂的名称为______,装置E中无水氯化钙的作用是 ________.。
(4)装置B残留固体中除NaCl外还含有一种酸式盐M,写出装置B中发生反应的化学方程式 _______。
(5)证明残留固体中含有M的最简单的实验方案是: _______。
(6)测定残留固体中M的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1 mol/L 的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2 mL.。
①实验时用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、____。
②求残留固体中M的质量分数__________(用含m、V1和![]() 的代数式表示)。
的代数式表示)。
③若用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,测定结果将____填“偏高"、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com