
| A. | 1s22s22p5 | B. | 1s22s22p2 | C. | 1s22s22p63s1 | D. | 1s22s22p63s2 |
分析 失去同一能级电子时,电离能相差不大,失去同一能层中不同能级电子时,电离能相差较大,到失去不同能层电子时,电离能发生剧增.
解答 解:A.第一电离能与第二电离能均失去2p能级电子需要能量,相差不大;
B.第一电离能与第二电离能均失去2p能级电子需要能量,相差不大;
C.失去一个电子后,电子排布变为1s22s22p6,为稀有气体的稳定结构,第二第二电离能为失去2p能级电子需要能力,所以第二电离能与第一电离能很大;
D.第一电离能与第二电离能均失去3s能级电子需要能量,相差不大,
故选:C.
点评 本题考查原子核外电子的排布、电离能,侧重于基础知识的考查,理解电离能与原子核外电子的排布特点的关系.


科目:高中化学 来源: 题型:选择题
| A. | SO2有漂白性,工业上常用它来漂白纸浆 | |
| B. | 单质硅具有半导体性能,可以制成光电池 | |
| C. | Fe2O3是一种红棕色粉末,常用作红色油漆 | |
| D. | 明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
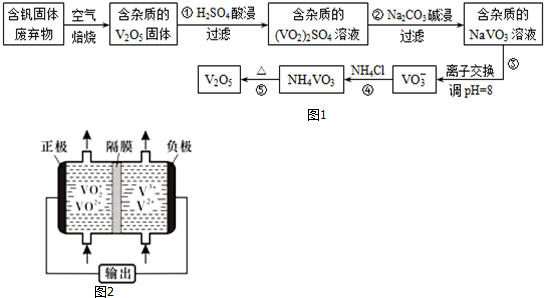
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所需仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平 | |
| B. | 将量取的浓盐酸先倒入容量瓶,再加入蒸馏水至刻度线,摇匀 | |
| C. | 将溶液转移入容量瓶,要用玻璃棒引流 | |
| D. | 定容时仰视刻度,所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图a中,随着电解的进行,溶液中c(H+)增大 | |
| B. | 图b中,Mg电极做电池负极 | |
| C. | 图c中,发生的反应为Co+Cd2+=Cd+Co2+ | |
| D. | 图d中,K分别与M、N连接,Fe电极均受到保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中一定不存在FeO | |
| B. | Y中一定含有MnO2,Fe2O3 | |
| C. | Z溶液中一定含有Na2SO4,不能确定是否含有AlCl3 | |
| D. | 不溶物Y中一定含有Fe和CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向盛有某溶液的试管中滴加NaOH溶液,将湿润的红色石蕊试纸放在试管口 | 试纸未变蓝 | 该溶液中不含NH4+ |
| B | 用高锰酸钾溶液检验乙烯中混有的SO2 | 高锰酸钾溶液褪色 | 乙烯中混有SO2 |
| C | 向氯化钡溶液中通入CO2 | 得到白色沉淀 | 生成了BaCO3 |
| D | 淀粉KI溶液中滴入氯水,再通入SO2 | 先变蓝后褪色 | SO2有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com