
[化学——选修2:化学与技术](15分)磷矿石主要以磷酸钙[Ca3(PO4)2 H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程。
H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程。
图(a)
图(b)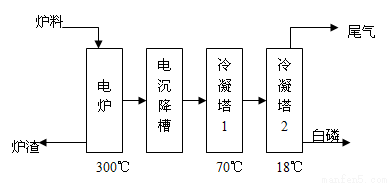
部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
(1)69%(2分)
(2)Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑(2分) 0.49t(2分)
(3)CaSiO3,(1分),液体白磷(1分);固体白磷。(1分)
(4)CO、SiF4;(2分)H2S、HF、SiF4(2分),PH3。(1分)
(5)产品纯度高或产品浓度大(1分)
【解析】
试题分析:(1)工艺流程图(a)可知生产含磷肥料有磷矿粉肥和磷肥,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%;(2)由题目知以磷矿石用过量的硫酸溶解制得磷酸,所以Ca5F(PO4)3与硫酸反应,根据质量守恒定律可写出反应的化学方程式:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
设商品磷酸的质量为m根据P守恒可得关系式:
P2O5 ~ 2H3PO4,
142 196
1t×30% m×85%
解得:m=0.49t
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;
由表中数据可知白磷熔点为44℃,沸点为280.5℃,冷却塔1的温度是70℃,高于44℃但低于280.5℃,所以此时以液态白磷的形式存在;冷却塔2的温度是18℃,低于白磷的熔点,故此时的主要沉积物是固体白磷;(4)由工艺原料可知:可能的反应还有SiO2+4HF=SiF4↑+H2O,2C+O2=2CO,因此在尾气中含有少量的PH3、H2S和HF等外,主要含有SiF4、CO;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3;(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但其优点是所得产品纯度高或产品浓度大。
考点:了解化学科学发展对自然资源利用的作用。了解精细化工产品的生产特点、精细化工在社会发展中的作用。理解质量守恒定律的含义,能根据化学方程式进行有关


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
磷是重要的非金属元素。
28.1.有关的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.2.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.3.25℃时,HF的Ki = 3.6×10 – 4 ;H3PO4的 Ki1= 7.5×10 -3,Ki2= 6.2×10 -8,Ki3= 2.2×10 -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.4.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各1.5mol,Mg2+为0.5mol,则SO42-的物质的量是
A.0.25 mol B.0.5mol C.0.75mol D.0.75mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列有关化学用语正确的是
①乙烯的最简式C2H4 ②乙醇的结构简式C2H6O
③四氯化碳的电子式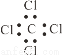 ④乙炔的结构简式CHCH
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3 ⑥乙醛的结构简式CH3COH
A.全对 B.全错 C.③④⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S 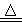 6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物又是还原产物
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D.该反应中氧化产物与还原产物的质量比为1∶6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中一定含有Ag+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
C | 用石墨作电极电解MgSO4溶液 | 某电极附近有白色沉淀生成 | 该电极为阳极 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,

化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:简答题
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
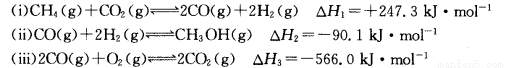
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:


①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列常见金属的冶炼原理中不合理的是
金属 | 冶炼原理 | |
A | Fe | Fe2O3+3CO= |
B | Hg | 2HgO |
C | Mg | 2MgO(熔融)= |
D | Na | 2NaCl(熔融)= |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com