
| A. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Cl2通入水中 Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向浓盐酸中加二氧化锰:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑ |
分析 A.电荷不守恒;
B.Al2(SO4)3溶液中加入过量Ba(OH)2溶液,铝离子生成偏铝酸根离子;
C.次氯酸为弱酸,应保留化学式;
D.二者反应生成氯化锰、氯气和水.
解答 解:A.钠加入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.Al2(SO4)3溶液中加入过量Ba(OH)2溶液,铝离子生成偏铝酸根离子,离子方程式:3Ba2++4OH-+Al3++3SO═3BaSO4↓+AlO2-+2H2O,故B错误;
C.Cl2通入水中,离子方程式:Cl2+H2O?H++HClO+Cl-,故C错误;
D.向浓盐酸中加二氧化锰,离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确发生反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,选项B为易错选项.


科目:高中化学 来源: 题型:选择题
| A. |  装置依据U管两边液面的高低判断Na和水反应的热效应 | |
| B. | 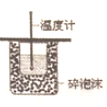 装置依据测定酸碱中和反应的中和热 | |
| C. | 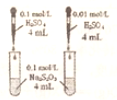 装置依据出现浑浊的先后顺序,比较浓度对反应速率的影响 | |
| D. | 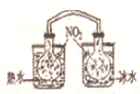 装置依据两容器内气体颜色变化,判断反应2NO${\;}_{{2}_{\;}}$(g)?N2O4(g)平衡移动的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔化状态下能导电的物质一定是离子化合物 | |
| B. | 单质分子中一定含有共价键 | |
| C. | 只由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在煤油层上,不反应 | |
| B. | 钠沉在煤油层下,不反应 | |
| C. | 钠沉在煤油层下浮在水层上,在交界处剧烈反应 | |
| D. | 钠沉在水层下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
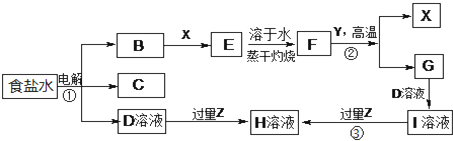
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| B. | MgCO3与NaOH溶液反应生成沉淀:MgCO3+2OH-═Mg(OH)2↓+CO32- | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 向NH4HSO4溶液中滴加过量NaOH溶液:NH4++HSO4-+2OH-═SO42-+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
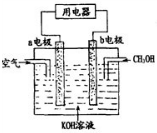 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
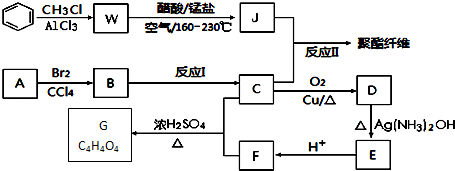
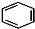 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$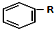 +HCl(-R为烃基)
+HCl(-R为烃基)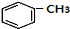 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$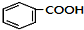
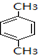 .
. .
.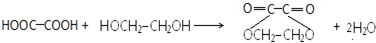 .
.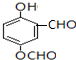 (写出一种即可);
(写出一种即可);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com