
A、原硫酸铜溶液的密度为ρ=
| ||
B、原硫酸铜溶液的物质的量浓度为c(CuSO4)=
| ||
C、原硫酸铜溶液的质量分数ω(CuSO4)=
| ||
D、生成硫酸铜晶体的物质的量为
|
| m |
| V |
| n |
| V |
| m |
| M |
| ag |
| VmL |
| (a-b)g |
| 250g/mol |
| a-b |
| 250 |
| ||
| V×10-3L |
| 4(a-b) |
| V |
| a-b |
| 250 |
| ||
| ag |
| 64(a-b) |
| a |
| (a-b)g |
| 250g/mol |
| a-b |
| 250 |


科目:高中化学 来源: 题型:
| A、稀释后,溶液中各离子浓度均变小 | ||||
| B、原溶液中,C(Na+)=C(HCO3-)+C(H2CO3)=0.1mol/L | ||||
C、稀释后,溶液中
| ||||
| D、原溶液加入少量NaOH溶液后,其碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、置换反应一定属于氧化还原反应 |
| B、离子反应一定属于氧化还原反应 |
| C、有的复分解反应属于氧化还原反应 |
| D、所有化合反应都属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
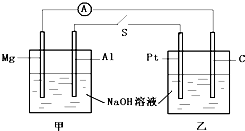 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )| A、电流计指针不发生偏转 |
| B、Al、Pt两电极有氢气生成 |
| C、Mg、C两电极生成的气体在一定条件下可以恰好完全反应 |
| D、甲池pH减小,乙池pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甲烷的电子式: |
B、氮原子的L层电子轨道表示式: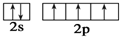 |
| C、硫离子的核外电子排布式:1s22s22p63s23p4 |
| D、碳原子最外层电子排布:2s22p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、②③④ |
| C、①②③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:+ 4 |
+ 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com