
| A. | 氨水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| D. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 |
分析 A.氨水稀释促进电离,溶液中氢氧根离子浓度减小,电离平衡常数不变;
B.碳酸钠是强碱弱酸盐,加水稀释促进水解,水解程度增大,氢氧根离子浓度减小,溶液碱性减弱;
C.电解精炼铜,粗铜做阳极,精铜做阴极,阳极是铜、杂质锌、铁、镍等金属失电子发生氧化反应,阴极是溶液中铜离子得到电子生成铜;
D.反应自发进行的判断依据是△H-T△S<0.
解答 解:A.氨水稀释促进电离,溶液中氢氧根离子浓度减小,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kb}{c(O{H}^{-})}$,电离平衡常数不变比值增大,故A错误;
B.碳酸钠是强碱弱酸盐,加水稀释促进水解,水解程度增大,氢氧根离子浓度减小,溶液碱性减弱,pH减小,故B正确;
C.电解精炼铜,粗铜做阳极,精铜做阴极,阳极是铜、杂质锌、铁、镍等金属失电子发生氧化反应,阴极是溶液中铜离子得到电子生成铜,电子守恒分析可知阳极质量减少和阴极质量增加不相同,故C错误;
D.298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)反应△S<0,能自发进行,反应自发进行的判断依据是△H-T△S<0,则其△H<0,故D正确;
故选BD.
点评 本题考查了弱电解质电离平衡、盐类水解影响因素、电解原理、反应自发进行的判断依据等知识点,掌握基础是解题关键,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
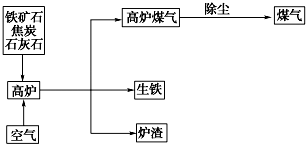
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
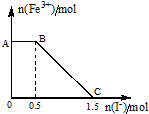 (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
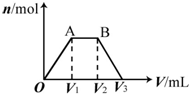 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
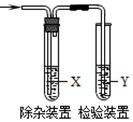 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com