
加水稀释,在乙图中画出pH值的变化图像
加水稀释相同的倍数,________的pH大;
加水稀释到相同的pH值,________加入的水多。
科目:高中化学 来源: 题型:
氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
A.直线 sp杂化 B.V型 sp2杂化
C.三角锥形 sp3杂化 D.平面三角形 sp2 杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中能量变化如图所示,下列有关叙述正确的是( )
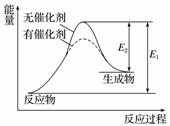
A.该反应为放热反应
B.催化剂改变了化学反应的热效应
C.催化剂不改变化学反应过程
D.催化剂改变了化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO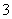 、CO
、CO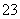 、ClO-结合H+的能力由强到弱的顺序为____________。
、ClO-结合H+的能力由强到弱的顺序为____________。
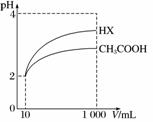
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 mol·L-1醋酸溶液、0.1 mol·L-1盐酸、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。
(1)甲取出10 mL 0.1 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是__________________________,
理由是________________________________________________________________________。
(2)乙分别取pH=3的醋酸和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是________________________________________________________________________。
(3)丙分别取pH=3的盐酸和醋酸各10 mL,然后加入质量相同的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?________,请说明理由:_____________________________。
(4)丁用CH3COONa晶体、NaCl晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,充电时,总反应为Na2Sx === 2Na + xS(3<x<5),其反应原理如图所示,下列说法错误的是( )
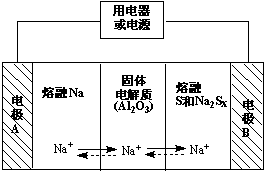
A.放电时,电极A为负极
B.该电池工作的适宜温度应控制10℃左右
C.放电时,内电路中Na+的移动方向为A到B
D.充电时,阳极的电极反应式为 Sx2- - 2e- === xS
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是 , 违反了洪特规则的是 。
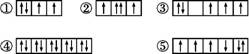
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子
排布式为 ;其最高价氧化物对应水化物的化学式是 。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na Mg, Mg Ca。
②电负性:O F, F Cl。
③能量高低:ns (n+1)s, ns np。
④主族序数 价电子数 元素最高正化合价。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com