

 .步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示.
.步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示.
分析 铁泥(主要成分为Fe2O3、FeO和少量Fe)与稀盐酸反应得到的滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液B的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,据此分析解答.
解答 解:铁泥(主要成分为Fe2O3、FeO和少量Fe)与稀盐酸反应得到的滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子:2Fe3++Fe=3Fe2+,过滤过量的铁,滤液B的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,向浑浊液中加入双氧水氧化:2Fe(OH)2+H2O2=2FeOOH+2H2O,反应完成后需再加热一段时间除去剩余H2O2,再与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O,过滤、洗涤、干燥得产品Fe3O4,
(1)步骤②中,滤液A溶质为氯化铁、氯化亚铁、过量的稀盐酸,加入铁粉还原铁离子和反应过量的盐酸:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(2)滤液B的溶质为氯化亚铁,加入氢氧化钠溶液,生成Fe(OH)2浑浊液,Fe2+在pH=6.3时开始沉淀,在pH=8.3时沉淀完全,所以用NaOH溶液调pH至9使亚铁离子沉淀完全;
故答案为:使亚铁离子沉淀完全;
(3)Fe(OH)2浑浊液中加入双氧水氧化,反应后浊液D中铁元素以FeOOH形式存在,则反应的离子方程式为:2Fe(OH)2+H2O2=2FeOOH+2H2O;
故答案为:2Fe(OH)2+H2O2=2FeOOH+2H2O;
(4)a.步骤④中,反应完成后需再加热一段时间除去剩余H2O2,故a正确;
b.FeOOH与氯化亚铁加热搅拌发生反应:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O,反应消耗碱,所以步骤⑤中,反应过程中需要不断补充碱液,故b正确;
c.步骤⑤恰好反应时,发生反应:2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O,由方程式可知:n(FeOOH)/n(Fe2+)=2:1,故c正确;
d.设浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b,则滤液B中与FeOOH反应的亚铁离子物质的量为b-a,由图可知 =1.75时,Fe3O4的产率最高,则$\frac{a}{b-a}$=1.75,解得:$\frac{a}{b}$=$\frac{7}{11}$,故d错误;
=1.75时,Fe3O4的产率最高,则$\frac{a}{b-a}$=1.75,解得:$\frac{a}{b}$=$\frac{7}{11}$,故d错误;
故答案为:abc.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等,侧重于考查学生的分析能力和应用能力.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl(s)═NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率均增大 | |
| C. | 铅蓄电池放电时的负极和充电时的阳极均发生还原反应 | |
| D. | 镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数为6 | B. | 该配合物可能是平面正方形结构 | ||
| C. | Cl-和NH3分子均与Pt4+形成配位 | D. | 该配合物的配体只有NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的苯酚(溴水) | B. | 乙醇中的水(新制的氧化钙) | ||
| C. | 苯酚中的乙酸(饱和碳酸钠溶液) | D. | 乙酸乙酯中的乙酸(乙醇) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
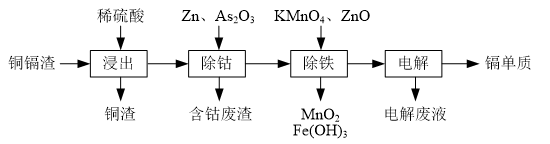
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片做阴极,石墨做阳极 | |
| B. | 白色沉淀在阴极附近生成 | |
| C. | 阳极区溶液变蓝的原因是:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 | |
| D. | 阳极区溶液变蓝的原因是:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量铜与一定量浓硫酸加热反应,先产生二氧化硫,后产生氢气 | |
| B. | 向Ba(OH)2溶液中通CO2至过量,先生成白色沉淀,后沉淀溶解 | |
| C. | 向(NH4)2Fe(SO4)2溶液中滴加少量NaOH溶液,NH4+先发生反应 | |
| D. | 向等浓度的FeCl3和CuCl2混合溶液中加入少量Fe粉,Cu2+先被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com