已知Fe(NO
3)
2受热分解产物为金属氧化物、NO
2、O
2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:
【提出假设】
(1)对固体产物中Fe化合价的猜想
猜想一:只显+2价;猜想二:只显+3价;猜想三:
.
【实验验证】
(2)同学们设计并验证试验,取适量上述加热分解后的固体于试管中,加入足量的0.1mol/L H
2SO
4溶液,使固体完全溶解,再进行下列实验操作,实验结果证明溶液中只含有Fe
3+,不含有Fe
2+.
(提示:由于浓度较稀,不能以Fe
3+和Fe
2+例子本身的颜色进行确认)
A、先向试管中滴入KSCN溶液,溶液呈红色,再向试管中滴加3%的H
2O
2溶液,溶液呈红色.
B、先向试管中滴入3%的H
2O
2溶液,无明显变化,再向试管中滴入KSCN溶液,溶液呈红色.
C、先向试管中滴入0.01mol/L的高锰酸钾溶液,溶液呈紫色,再向试管中滴入KSCN溶液,溶液呈红色.
D、先向试管中滴入KSCN溶液,溶液呈红色,再向试管中滴加K
3[Fe(CN)
6]溶液,溶液无明显变化.
【实验结论】
(3)根据上述实验结果,证明猜想二正确,请写出Fe(NO
3)
2热分解的化学方程式
.
【实验改进】
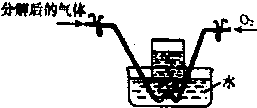
(4)有同学提出也可以通过测定分解后的气体体积的方式进行分析,于是将分解后的气体进行右图装置的试验,以验证猜想:先向集气瓶中通入分解后的气体,记录通入气体的体积为V
1,然后,打开右侧止水夹,再向吸气瓶中缓慢通入O
2,观察到的现象是:
.摇动集气瓶,液面上升,当液体充满集气瓶时,记录通入氧气瓶的体积为V
2.当通入的氧气为V(O
2)=
(用含V
1的代数式表示),证明猜想二成立.

 已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:
已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案