
在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)  2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
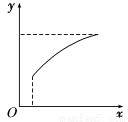
选项 | x | y |
A | 再通入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:填空题
将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)的体积是________ L。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:填空题
现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是____________。
(3)已知t°C,KW=1×10-13,则t°C______(填“>”、“<”或“=”)25°C。
(4)25°C时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和。两溶液的pH(x、y)的关系式为________________(填表达式)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.在Na2CO3溶液中滴入酚酞试液,呈红色
B.(NH4)2SO4溶液中c(NH )∶c(SO
)∶c(SO )=2∶1
)=2∶1
C.FeCl3溶于水使溶液呈酸性,从而抑制水的电离
D.将Al2(SO4)3溶液蒸干得到Al(OH)3固体
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:实验题
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 |
|
|
|
|
③ |
| 298 | 10 | 6.0 | 0.30 |

[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
有一化学平衡mA(g)+nB(g)  pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
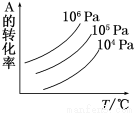
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+n<p+q
C.正反应是放热反应;m+n<p+q
D.正反应是吸热反应;m+n>p+q
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
[双选题]实验室用锌粒与2 mol·L-1硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
A.向该硫酸溶液中加入等体积的水
B.改用3 mol·L-1盐酸
C.改用热的2 mol·L-1硫酸溶液
D.用锌粉代替锌粒
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和H2O(l)时,放出445 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890 kJ/mol
D. CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l)ΔH=-890 kJ/mol
CO2(g)+H2O(l)ΔH=-890 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
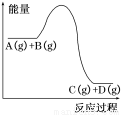
A.该反应的正反应为放热反应
B.升高温度,利于A的转化率增大
C.加入催化剂时,该反应的反应热发生改变
D.增大压强,能够加快反应达到平衡状态的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com