
����Ŀ������ȩ��һ�ֻ���ԭ�ϡ�ijʵ��С��������ͼװ�úϳ�����ȩ�������ķ�Ӧ���£�![]() ��
��

��Ӧ��Ͳ������������б����£�
�е�/�� | �ܶ�/��gcm-3�� | ˮ���ܽ��� | |
������ | 117.2 | 0.8109 | �� |
����ȩ | 75.7 | 0.8017 | �� |
��֪��ȩ���ɱ�����Na2Cr2O7������
ʵ�鲽�����£�
��6.0gNa2Cr2O7����100mL�ձ��У���ˮ30mL�ܽ⣬�ٻ�������5mLŨ���ᣬ��������ҺС��ת����B�С���A�м���4.0g�������ͼ�����ʯ�����ȡ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90��95�棬��E���ռ�90�����ϵ���֡�������ﵹ���Һ©���У���ȥˮ�㣬�л������������ռ�75��77����֣�����2.0g���ش��������⣺
��1��ʵ���У��ܷ�Na2Cr2O7��Һ�ӵ�Ũ�����У�˵������__________________��
��2�������ʯ��������______________�������Ⱥ���δ�����ʯ��Ӧ��ȡ����ȷ��ʩ��______________________________��
��3������װ��ͼ�У�B������������_____________��D������������_______________��
��4����Ӧ�¶�Ӧ������90��95�棬��ԭ����___________________________��
��5���¶ȼ�C1������_________________��C2������_______________��
��6����ʵ���У�����ȩ�IJ���Ϊ_________����
���𰸡� ���ܣ�Ũ��������ˮ��ų�������,���������� ��ֹ���� ����Һ��ȴ�����º��ټӷ�ʯ ��Һ©�� ֱ�������� ��֤����ȩ��ʱ����,�ֿɾ��������䱻��һ������ ������ƿ�з�Ӧ����¶� ������ֵķе� 51
����������1������Ũ������ܶȴ�����ˮ�������Ž�������
��2�������ʯ�������Ƿ�ֹ���У������Ⱥ���δ�ӷ�ʯ��ֹͣ���ȣ���ȴ�ӣ�
��3���������������ж��������ƣ�
��4��������Ŀ������Ӧ��Ͳ���ķе����ݷ�����
��5�������¶ȼ�ˮ�����λ�÷����жϣ�
��6��������ȩ�IJ���Ϊx������������������Ϊx�����ݹ�ϵʽC4H10O��C4H8O�з��̼��㡣
��1����ΪŨ������ܶȴ�Na2Cr2O7��Һ�ӵ�Ũ�����У��������Ž����ˣ����ܽ�Na2Cr2O7��Һ�ӵ�Ũ�����У�
��2�������ʯ�������Ƿ�ֹ���У������Ⱥ���δ�ӷ�ʯ��Ӧ��ȡ����ȷ�����ǣ�����Һ��ȴ�����º��ټӷ�ʯ��
��3���������������֪B�����������Ƿ�Һ©����D����������ֱ�������ܣ�
��4��������Ŀ������Ӧ��Ͳ���ķе����ݿ�֪����Ӧ�¶ȱ�����90��95�棬�ȿɱ�֤����ȩ��ʱ�������ֿɾ��������䱻��һ��������
��5���¶ȼ�C1����������ƿ�У�����������Dz�����ƿ�з�Ӧ����¶ȣ��¶ȼ�C2����֧�ܳ��ڴ�������������Dz�����ֵķе㡣
��6��������ȩ�IJ���Ϊx������������������Ϊx�����ݹ�ϵʽ��֪
C4H10O��C4H8O
74 72
4xg 2g
���x=74��2/(72��4)��100%��51%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨʯ��ʯ��Ʒ��̼���(��SiO2����)�ĺ�������������ͼ��ʾװ�ý���ʵ�飬��ַ�Ӧ�ⶨװ��C�����ɵ�BaCO3��������������˵����ȷ����

A. װ��A��ҩƷӦΪŨ����
B. ��B��C֮��Ӧ����ʢ�б���NaHCO3��Һ��ϴ��װ�ã��Գ�ȥ�Ȼ�������
C. ֻҪ�ⶨװ��C������CO2ǰ��������Ҳ����ȷ��̼��Ƶ���������
D. Ϊ�˲��C�����ɵij����������辭�����ˡ�ϴ�ӡ���������Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. �ױ���Һ�����ȡ������Ϊ![]()
B. �ұ��������������ɲ�����11��
C. ����ʽΪC5H10O2�����������ͬ���칹�干�����������칹��7��
D. 2-��-2-��ϩ������˳���칹
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20ml 0.1molL��1NaOH��Һ����μ���0.2molL��1������Һ���ζ�������ͼ��ʾ���й�����Ũ�ȵĹ�ϵ�У�����ȷ���ǣ������� 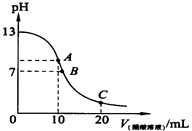
A.��A�㣺c��Na+����c��OH������c��CH3COO������c��H+��
B.��B�㣺c��Na+����c��CH3COO������c��OH������c��H+��
C.��C�㣺c��CH3COO������c��Na+����c��H+����c��OH����
D.��C�㣺c��CH3COO����+c��CH3COOH����2 c��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp��CaSO4��=9��10��6 �� CaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ������� 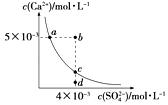
A.CaSO4��ϡ�����е��ܽ��Ա��ڴ�ˮ�е��ܽ���ǿ
B.a���Ӧ��Ksp����c���Ӧ��Ksp
C.d����Һͨ���������Ա䵽c��
D.b�㽫�г������ɣ�ƽ�����Һ��c��SO42����һ������3��10��3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����У�������֬�����ʵ��ǣ� ��
A. ά����D B. ���̴� C. ���Լ��� D. ֬��ø
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��Һ�п��ܴ��ڵ���ƽ�⡢ˮ��ƽ��ͳ����ܽ�ƽ�⣺
��1��ʵ����0.1molL��1һԪ����HA ��pHΪ4����HA�ĵ���ƽ�ⳣ��Ka=
��2����AlCl3��Һ��������������ù���Ϊ���ѧʽ����
��3��NaHCO3��Һ�д��ڵ�ƽ������������ֱ������ӷ���ʽ��ʾ��H2OH++OH������ ��
��4�������ʵ���Ũ�ȵ�NH4HSO4��Һ��NH4Cl��Һ��Ƚϣ�c��NH4+����ǰ�����ߣ����������������=������
��5����֪298Kʱ��Mg��OH��2���ܶȻ�����Ksp=5.6��10��12 �� ��0.1molL��1MgCl2��Һ�μ��ռ���Һ��pH=11����ʱc��Mg2+��= molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϩ���Ҵ��Ļ�ѧ���ʣ��Ʋ��ϩ��(CH2=CH��CH2OH)���ɷ����Ļ�ѧ��Ӧ�У� ��
A.�ӳɷ�ӦB.�ۺϷ�Ӧ
C.ȡ����ӦD.��Na2CO3��Һ��Ӧ�ų�CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ѧƽ�⣺mA��g��+nB��g��pC��g��+qD��g������ͼ��ʾ����A��ת������ѹǿ���¶�T�Ĺ�ϵ������ͼ�����߿��Եó��Ľ����ǣ�������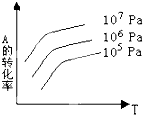
A.����Ӧ���ȣ�m+n��p+q
B.����Ӧ���ȣ�m+n��p+q
C.����Ӧ���ȣ�m+n��p+q
D.����Ӧ���ȣ�m+n��p+q
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com